(原创)用以下几种常见有机物填写下列空白:
a.CH4
b.C2H4
c.C6H6
d.C2H5OH
e.CH3COOH
(1)等质量的CH4、C2H4、C6H6三种烃完全燃烧消耗O2的量由多到少的顺序是 (用序号表示)。
(2)等物质的量混合的甲烷和乙酸蒸气完全燃烧所得二氧化碳和水蒸气的物质的量之比为 。
(3)由乙烯和乙醇蒸气组成的混合气体1mol完全燃烧所需氧气在标准状况下的体积为 L。
(4)由两种气态烃组成的混合气体完全燃烧后,将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收)。

| |
实验前 |
实验后 |
| (干燥剂+U形管)的质量 |
101.1 g |
104.7 g |
| (澄清石灰水+广口瓶)的质量 |
312.0 g |
318.6 g |
根据实验数据填空:
①假设广口瓶里生成一种正盐,其质量为 g。
②混合气体中C、H两元素的物质的量之比为 。
③若混合气体是由CH4和C2H4组成,则二者的体积比为 。
(15分)下表为元素周期表中的前四周期元素,列出了10种元素在元素周期表中的位置。试用元素符号、离子符号或化学式回答下列问题。
(1)元素⑦可形成18电子的氢化物X其电子式为,⑥与⑨形成的5原子分子的结构式为。
(2)①②③④⑤五种元素最高价氧化物对应水化物中,碱性最强的是(填化学式),该物质内部含有的化学键类型是。
(3)④形成的简单离子的结构示意图。
(4)第五周期元素中,与⑨元素同主族的元素原子序数为,用一个离子方程式比较该元素与⑨元素的非金属性强弱。
(5)⑦的氢化物比⑧的氢化物的熔沸点高的原因是___ __
(6)⑤的单质与①的最高价氧化物对应的水化物反应的离子方程式为。
X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大。已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8。
(1)元素W在周期表中的位置。
(2)用电子式表示X在空气中生成的氧化物的形成过程:。
(3)X、Y、Z、W的原子半径由大到小的顺序为:。(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的离子方程式:。
合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2 (s) + H2O(l) ==2 NH3(g)+CO2(g) △H =" +133.6" kJ/mol。该反应的化学平衡常数的表达式K=。关于该反应的下列说法正确的是(填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气。
结合①中信息,尿素还原NO(g)的热化学方程式是。
②密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g) +2NH3(g)==CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[(NH3)]随时间变化关系如图所示。则a点的正反应速率V(正)(CO2)b点的逆反应速率V(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是。
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2 g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,此反应的离子方程式是;恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>______。
选考【化学——选修5,有机化学基础】高聚酚酯 是一种环保型的新涂料,其合成路线如下图所示:’
是一种环保型的新涂料,其合成路线如下图所示:’
请回答下列问题:
(1)P的分子式为________,反应①属于________反应,反应①还有多种有机副产物,其中能使溴的CCl4溶液褪色的副产物的结构筒式为________。
(2)若反应②中两种反应物物质的量之比为1:1,则除A外另一种产物的名称是________,E是高分子化台物,其结构筒式为________。
(3)C转化为D的化学方程式是______________________.
(4)B有多种同分异构体,符舍下列条件的同分异构体共有_____种,其中校磁共振氢谱中有6组峰的是_________(写出其中一种的结构简式)。
①能与NaHCO3溶液反应
②遇3溶液显紫色
③分子中含一个-CH3
(5)由 合成B的另一种途径为
合成B的另一种途径为
则F中官能团名称是_________,H的结构简式为_________,试剂G的化学式_________。
选考【化学——选修3:物质结构与性质】(15分)四种常见元素的性质或结构信息如F表所示,请问答下列问题。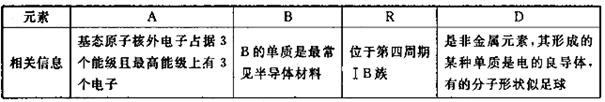
(1)R的基态原子价层电子排布式为________,这四种元素的第一电离能由大到小的顺序为________________(写元素符号)。
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为_______,任意写出一种中心原子存在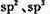 两种杂化类型的物质的结构简式________,与A的常见单质互为等电子体的上述元素的氧化物是________。
两种杂化类型的物质的结构简式________,与A的常见单质互为等电子体的上述元素的氧化物是________。
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中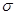 键之比为________,已知有下列两种数据:
键之比为________,已知有下列两种数据:
请解释键能大小与两种氧化物熔点、沸点高低差异过大的原因________。
(4)在一定条件下,Cl-与R2+可形成一种无限长链离子,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氧与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为________。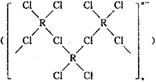
(5)A元素能形成组成为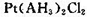 的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是________(填“极性”或“非极性”)分子,
②P的结构简式为________(AH3配体作为一个整体写)。