磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
写出由磷酸钙矿制取白磷总的反应方程式____________。
(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间(已知磷酸的各级电离常数为:K1 = 7.1×10−3 K2 = 6.3×10−8 K3 =4.2×10−13 lg7.1≈0.9 lg6.3≈0.8 lg4.2≈0.6) 。Na2HPO4溶液显碱性,若向其溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O= 20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
在一容积为3 L的密闭容器内加入0.3 mol的N2和0.9 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)  2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:(1)根据图示,计算从反应开始到平衡时,平均反应速率v(NH3)________。(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:(1)根据图示,计算从反应开始到平衡时,平均反应速率v(NH3)________。(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为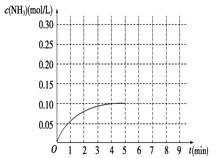
a.0.20 mol/L b.0.12 mol/Lc.0.10 mol/L d.0.08 mol/L
(3)反应达到平衡后,第5分钟末,保持其它条 件不变,若只把容器的体积缩小一半,平衡移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数_(填“增大”、“减小”或“不变”)
件不变,若只把容器的体积缩小一半,平衡移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数_(填“增大”、“减小”或“不变”)
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g) 4C(g)
4C(g)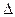 H >0达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B
H >0达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B 的起始浓度c(B)的取值范围是;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
的起始浓度c(B)的取值范围是;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
①增加C的物质的量②加压③升温④使用催化剂
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1m2(选填“<”、“=”、“>”)
阅读下面两条科普信息,回答问题:①一个体重为50kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形 式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血病人补铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。②在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)
式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血病人补铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。②在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)
(1)这两则科普信息分别介绍了人体内和海水中亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明亚铁离子具有性,铁离子具有性。
(2)①中的维生素C是剂。②中的CO2是剂,CH2O是产物。
(3)已知含Fe3+的盐可用于净水,因为水解生成的氢氧化铁胶体具有吸附性,写出实验室制备氢氧化铁胶体的离子方程式
有一包白色固体粉末,其中可能含有NaCl、BaCl2、Cu (NO3)2、Na2CO3中的。一种或几种,现做以下实验:
(NO3)2、Na2CO3中的。一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)写出原白色粉末中一定含有的物质的化学式
(2)写出原白色粉末中一定不含的物质的电离方程式
(3)写出下列各步变化的离子方程式:
②
④
根据反应8NH3 + 3Cl2 ="=" 6NH4Cl + N2 ,回答下列问题:
(1) 还原剂是(写化学式);
(2) 用双线桥法表示该反应电子转移的方向和数目;
(3)当反应中转移1.806×1024个电子时,被氧化的气体在标准状况下的体积为升。