煤化工中两个重要反应为①C(s)+H2O(g)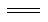 H2(g)+CO(g)ΔH=+131.3 kJ·mol-1,②CO(g)+ H2O(g)
H2(g)+CO(g)ΔH=+131.3 kJ·mol-1,②CO(g)+ H2O(g) CO2(g)+ H2(g)。
CO2(g)+ H2(g)。
(1)下列说法正确的是 。
| A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度 |
| B.反应②的熵变△S>0 |
| C.反应①中增加C固体的量能增大反应速率 |
| D.在反应中②及时分离出产生的H2对正反应速率无影响 |
(2)若工业上要增加反应①的速率,最经济的措施为 。
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/ min |
||
| CO |
H2O |
H2 |
CO2 |
|||
| I |
650 |
4 |
2 |
1.6 |
1.6 |
5 |
| Ⅱ |
900 |
2 |
1 |
0.5 |
0.5 |
3 |
| Ⅲ |
900 |
a |
b |
c |
d |
t |
①实验I中,从反应开始到反应达到平衡时,H2O的平均反应速率为___。
②CO(g)和H2O(g)反应的△H 0(填“大于”、“小于”或“等于”)
③实验III中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______,与实验Ⅱ相比,化学平衡常数 (填“增大”、“减小”或“不变”)。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1 mol CO、0.5 mol H2O、0.2 mol CO2、0.5 mol H2,平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)。
(4)CO、H2可用于甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g) CH3OH(g)ΔH= -mkJ·mol-1
CH3OH(g)ΔH= -mkJ·mol-1
反应②: 2CO(g)+4 H2(g) CH3OCH3(g)+H2O(g)ΔH=-nkJ·mol-1
CH3OCH3(g)+H2O(g)ΔH=-nkJ·mol-1
反应③:2CH3OH(g) CH3OCH3(g)+ H2O(g)△H<0
CH3OCH3(g)+ H2O(g)△H<0
则m与n的关系为 。
(1)称取乳酸0.90g,在某种状况下使其完全汽化,已知相同状况下同体积氢气为0.02g。则乳酸的相对分子质量为_________。
(2)若将上述乳酸蒸气在氧气中燃烧只生成CO2和H2O(g),当全部被碱石灰吸收时,碱石灰增重1.86g,若将此产物通入过量石灰水中,则会产生3.00g白色沉淀。则乳酸的分子式为_________。
(3)乳酸分子能发生自身酯化反应,其催化氧化产物不能发生银镜反应,葡萄糖发酵只生成乳酸,试写出生成乳酸的化学方程式______________________________________________
_______________________________________________________________________________。
(4)写出乳酸在催化剂作用下发生反应,生成化学式为C6H8O4的环状酯的结构简式______。

(1)上述平衡中的环状结构(乙)分子是通过链状结构(甲)分子中的__________基和__________基之间发生___________反应而生成的。
(2)现要制备一种链烃基醚 ,试写出由两种简单的有机物合成该烃基醚的化学方程式:___________________________________________________。
,试写出由两种简单的有机物合成该烃基醚的化学方程式:___________________________________________________。
(1)银镜反应时,需银氨络离子__________mol,反应后葡萄糖变为___________,其结构简式是__________。
(2)与乙酸反应生成酯,从理论上讲完全酯化需要__________g乙酸。
(3)若使之完全转化为CO2和H2O,所需氧气的体积在标准状况下为__________L,反应的方程式是_____________________________________________________________________
______________________________________________________________________________。

已知F、H均是具有香味的液体,F为E的三聚物,并且有特殊的六元环状对称结构。
(1)A的名称是________________________________________;
F的结构式为________________________________________;
H的同类物的异构体还有(写结构简式) ____________________________________________。
(2)写出D E的化学方程式:__________________________________________________。
E的化学方程式:__________________________________________________。
写出B C的离子方程式:____________________________________________________。
C的离子方程式:____________________________________________________。

试完成下列题目:
(1)化合物的结构简式:A__________;B__________;C__________。
(2)写出化学方程式并注明反应类型:
A E:____________________,__________;
E:____________________,__________;
A F:____________________,__________。
F:____________________,__________。