[化学选修——5:有机化学基础]立方烷(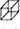 )具有高度的对称性.高致密性.高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
)具有高度的对称性.高致密性.高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:

回答下列问题:
(1)C的结构简式为 ,E的结构简式为 。
(2)③的反应类型为 ,⑤的反应类型为
(3)化合物A可由环戊烷经三步反应合成:

反应1的试剂与条件为 ;反应2的化学方程式为 ;反应3可用的试剂为 。
(4)在I的合成路线中,互为同分异构体的化合物是 (填化合物代号)。
(5)I与碱石灰共热可转化为立方烷。立方烷的核磁共振氢谱中有 个峰。
(6)立方烷经硝化可得到六硝基立方烷,其可能的结构有 种。
【改编】氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+ H2O(g) CO(g)+ H2(g);
CO(g)+ H2(g);
②用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH=_____________。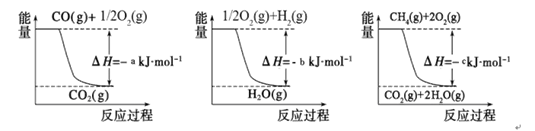
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
3 |
|
| N2的体积分数 |
ω1 |
ω2 |
ω3 |
| 混合气体密度(g·L-1) |
ρ1 |
ρ2 |
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4)分析上表数据,下列关系正确的是________。
a.2c1=3mol/L b.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=____ __(用分数表示)(mol/L)-2。
【改编】α,β不饱和化合物在有机合成中有着广泛的用途。反应①是合成α,β不饱和化合物的常见的方法。
反应①:
(1)化合物Ⅲ的分子中含氧官能团的名称为 ,1mol化合物Ⅰ完全燃烧消耗 molO2。
(2)下列说法中不正确的是 。
| A.反应①属于取代反应 |
| B.1mol化合物Ⅰ、Ⅲ与氢气完全加成均需要4mol氢气 |
| C.化合物Ⅰ、Ⅲ均能与NaHCO3溶液反应 |
| D.化合物Ⅲ与Br2既能发生取代反应,也能发生加成反应 |
(3)化合物Ⅳ可以通过化合物Ⅲ在一定条件下发生分子内的酯化得到;请写出该反应的化学方程式(注明必要的条件) 。
(4)符合下列条件的化合物Ⅳ的同分异构体有____种;
①遇氯化铁溶液显紫色;②能发生银镜反应;③苯环上只有三个取代基
(5)化合物 是由化合物Ⅴ与化合物Ⅱ发生类似反应①的反应得到的,则化合物Ⅴ的结构简式为 。在工业上化合物Ⅱ可以通过CH3CHO在一定条件下与氧气反应制得,在反应中除了生成化合物Ⅱ以外还有水生成,则该反应的化学反应方程式为 。
是由化合物Ⅴ与化合物Ⅱ发生类似反应①的反应得到的,则化合物Ⅴ的结构简式为 。在工业上化合物Ⅱ可以通过CH3CHO在一定条件下与氧气反应制得,在反应中除了生成化合物Ⅱ以外还有水生成,则该反应的化学反应方程式为 。
【原创】X、Y、Z是由1-18号元素组成的物质,它们之间存在如下转化关系。
X + H2O →Y + Z
(1)上述反应为氧化还原反应。
①若X和Y是同主族元素组成的单质,且组成X的元素位于第三周期,此反应的离子方程式是 。
②若Y和Z都可在一定条件下还原CuO,则此反应的化学方程式是 。
(2)上述反应为非氧化还原反应。
①若X是一种钠盐,Z为两性氢氧化物,则甲X的化学式为 ,Z的酸式电离方程式为 。
②若X是由N和Cl元素组成的化合物,其分子结构模型类似于氨气的结构模型,Y具有漂白性。则甲中Cl元素的化合价是 ,Z与H2O有相同的电子总数,则Z的电子式为 。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)写出CO燃烧的热化学方程式_____ ________;
(2)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
①温度升高该反应的平衡常数 (增大、减小、不变)
②B过程用H2表示该反应的化学反应速率是 mol·L-1·min-1
(4)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-==CO32-+3H2O,负极的反应式为 。
【改编】A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,请回答下列问题:
(1)写出A、B、两种元素的符号:A ,B 。
(2)B位于周期表中第 周期第 族。
(3)C的氢化物的电子式为 ;
(4)BC6作致冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的致冷剂,且BC6在温度高于45度以上时为气态,BC6属于 (填“离子”、“共价”)化合物。