(13分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
(1)若假设1成立,则实验现象是 (2分)。
(2)若假设2成立,则实验现象是有 (2分)。
(3)若固体放入足量稀硫酸中,经充分反应后,固体全部溶解,滴加KSCN试剂时,溶液不变红色,则证明假设 (1分)(填数字)成立,写出可能发生的离子方程式 (6分)。
(4)经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。实验小组欲用加热法测定Fe2O3的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Fe2O3的质量分数为 (2分)。
现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。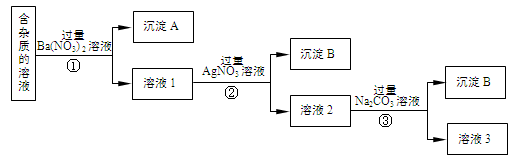
(1)沉淀A的主要成分是(填化学式)。
(2)②中反应的离子方程式是。
(3)①②③中均进行的分离操作是。
(4)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是,为了除去杂质,可向溶液3中加入适量的。
(5)实验室用上述实验获得的NaNO3固体配制500 mL 0.40 mol/L NaNO3溶液。
①配制溶液时,进行如下操作:a.定容;b.计算;c.溶解;d.摇匀;e.转移;f.洗涤;j.称量。称取NaNO3固体的质量是g。
按照操作顺序,第4步是(填序号)。
②某同学转移溶液的操作如图所示,该同学操作中的错误是。
③若用胶头滴管定容时,不小心滴水滴过了刻度线,你认为应该采取的处理方法是:。
④下列操作中,可能造成所配制溶液的浓度偏低的是(填选项)。
a.没有洗涤烧杯和玻璃棒
b.定容时,俯视刻度线
c.洗涤后的容量瓶中残留少量蒸馏水
为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。
实验一 探究铜和稀硝酸反应的产物。
实验装置如图,气密性已检查。
已知:FeSO4+NO=[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是。
(2)铜片和稀硝酸反应的化学方程式为。
(3)本实验A生成的气体中,若有NO2,B的实验现象为;若只有NO生成,B的实验现象是。
实验二 探究铜和稀硝酸反应速率先慢后快的原因
经过实验一,测得硝酸的浓度<6 mol•L-1,只有NO生成。当铜片与5 mol•L-1硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
探究一:研究反应过程的温度变化对反应速率的影响,实验所得曲线和现象记录如下图表。
| 时间/min |
现象 |
| 0~15 |
铜表面出现气泡,但速度很慢 |
| 25 |
溶液有很浅的蓝色,气泡生成速度加快 |
| 30 |
气泡生成速度较快,均匀冒出 |
| 45 |
洗气瓶中可见少量淡棕色的物质 |
| 50 |
溶液中蓝色明显变深,洗气瓶中突显明显棕色 |
(4)获得图2数据所需的测量仪器有________________________________。
(5)从上述图表分析可得到的结论是。
| 序号 |
温度 |
铜片/g |
硝酸/mL |
硝酸铜/g |
| 1 |
25℃ |
① |
② |
③ |
| 2 |
25℃ |
5 |
20 |
0.5 |
| 3 |
25℃ |
5 |
20 |
1.0 |
探究二:研究化学反应产物对反应速率的影响
设计了如下实验,利用上图装置测定溶液突显明显棕色的时间。
(6)请将上表中将实验1的实验条件填写完整①②③
(7)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是。
亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1 kg样品中含SO2的质量计),某研究小组同学设计了如下实验流程(所加试剂均为足量)。
 请回答:
请回答:
(1)亚硫酸盐作为食品添加剂的作用是(填字母)。
a.防腐保鲜b.增强营养
(2)反应①中通入N2的目的是(填字母)。
a.冷却产生的气体
b.与生成的气体反应
c.将生成的气体全部赶出
(3)反应①~③中属于氧化还原反应的是(填序号)。
(4)若取样品X g,反应③消耗0.01 mol/L NaOH溶液100 mL,则1 kg样品中含SO2的质量是g(用含X的代数式表示)。
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下,按下列合成步骤回答问题: (1)在加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了___________气体。继续滴加至液溴滴完。装置d的作用是,
(1)在加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了___________气体。继续滴加至液溴滴完。装置d的作用是,
写出a中有关反应化学方程式。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0 mL水、8 mL l0%的NaOH溶液、10 mL水洗涤。其中NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为__________________,要进一步提纯,下列操作中必须的是____________(填入正确选项前的字母);
A、重结晶B、过滤C、蒸馏 D、萃取
(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母)。
A、25 mLB、50 mLC、250 mLD、509 mL
(5)在最新的家用汽车的调查中发现,新车中气体的质量不符合标准。汽车污染主要来源于汽车配件及材料.它们都会产生大量有毒的有机物气体.其中一种有毒气体的质谱图如图:
①则由图可知该分子的相对分子质量是________。
②若该分子的核磁共振氢谱中有4个吸收峰则有机物的名称为_______。
③其苯环上的一氯代物有________种。
CuSO4溶液对过氧化氢的分解具有催化作用,有同学猜想其他盐溶液也能在这个反应中起同样的作用,于是他们做了以下的探究。
(1)请你帮助他们完成实验报告:
实验过程:在一支试管中加入5ml5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。
实验现象:①
实验结论:FeCl3溶液可以催化分解H2O2
(2)以知FeCl3在水中可解离出Fe3+和Cl-,同学们提出以下猜想:
甲同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是②同学的猜想,理由是③。
(3)同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表:
实验过程:向盛有5ml5%的H2O2溶液的试管中加入少量的HCl,并把带火星的木条伸入试管。
实验现象:无明显现象
结论④。
实验过程:向盛有5ml5%的H2O2溶液的试管中加入少量的⑤,并把带火星的木条伸入试管.
实验现象:⑥。
结论:⑦。