碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) =" 2" N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应如下:Fe2O3(s) + 3CH4(g)  2Fe(s) + 3CO(g) +6H2(g) ΔH>0
2Fe(s) + 3CO(g) +6H2(g) ΔH>0
① 若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为 ________________ 。
② 若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是_____(选填序号)
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③ 该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA ______KB(填“>”、“ <”或“=”)。纵坐标可以表示的物理量有哪些 。
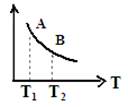
a.H2的逆反应速率
b.CH4的的体积分数
c.混合气体的平均相对分子质量
(3)若往20mL 0.0lmol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是________
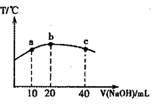
①该烧碱溶液的浓度为0.02mol·L-1
②该烧碱溶液的浓度为0.01mol·L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH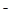 )> c(H+)
)> c(H+)
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下: ① NaBr+H2SO4 = HBr+NaHSO4;②R-OH+HBr R-Br+H2O
R-Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下
| 乙醇 |
溴乙烷 |
正丁醇 |
1-溴丁烷 |
|
| 密度/g·cm-3 |
0.7893 |
1.4604 |
0.8098 |
1.2758 |
| 沸点/℃ |
78.5 |
38.4 |
117.2 |
101.6 |
请回答下列问题:
(1)溴代烃的水溶性 (填“大于”、“等于”或“小于”)相应的醇;其原因是。
(2)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在(填“上层”、“下层”或“不分层”)。
(3)制备操作中,加入的浓硫酸必须进行稀释,目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是。
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为 ,XW的电子式为 ;
(2)Z元素在周期表中的位置是。
(3)元素U、V、W形成的10电子氢化物中,沸点较低的是(写化学式);结合H+能力较强的是(写化学式);用一个离子方程式加以说明。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为,由此可知VW和YW2还原性较强的是(写化学式)。
A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图,所示(图中球与球之间连线代表化学键单键或双键)。
(1)根据分子结构模型写出A的结构简式 ___________;
(2)拟从芳香烃 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下:
已知:A在酸性条件下水解生成有机物B和甲醇。
(a)写出⑤反应类型__________;写出H的结构简式 ___________
(b)已知F分子中含有“—CH2OH”,通过F不能有效、顺利地获得B,其原因是 _______
(c)写出反应方程式(注明必要的条件)
⑥ ________________________________________________________
⑦ __________________________________________________________
(3)A的同分异构体有多种,同时满足下列条件A的同分异构体有种:
ⅰ.含有苯环,苯环上有两个侧链且苯环上一氯取代物有两种;
ⅱ.与A有相同的官能团。
下面是C60、金刚石和二氧化碳的分子模型。
请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:_________________
(2)从晶体类型来看,C60属于_________晶体。
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是__________________________;晶体硅中硅原子与共价键的个数比为
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有________个二氧化碳分子,二氧化碳分子中 键与
键与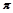 键的个数比为。
键的个数比为。
(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一。丙烷分子中2号碳原子的杂化方式是_______,丙烯分子中2号碳原子的杂化方式是_______,丙烯分子中最多有个原子共平面。
(1)二氧化硫的催化氧化的过程如图所示,其中a、c二步的化学方程式可表示为:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是(写化学式)
(2) 550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2在550 ℃时的平衡常数K=。
2SO2+O2在550 ℃时的平衡常数K=。
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应 达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度
B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2
D.再充入1 mol SO2和1 mol O2
(4)维持温度不变条件下使之发生如下反应:2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
试填写下列空格:
A容器达到平衡时所需的时间比B容器__________(填:“短或长”);平衡时A容器中SO2的转化率比B容器_______(填:“大或小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数_________(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数_________。