〔化学——选修3:物质结构与性质〕举世瞩目的中国探月工程三期再入返回试验器于2014年10月24日凌晨成功发射,为实现月球采样和首次地月往返踏出了成功的第一步。探月工程三期的主要目标是实现无人自动采样返回,突破月面采样、月面上升、月球轨道交会对接等核心关键技术。已知所用火箭推进剂为肼(N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。
请回答下列问题:
(1)N2H4、H2O2分子中电负性最大的元素在周期表中的位置为 ,第一电离能最大的元素为 。
(2)钛的原子序数为22,其基态电子排布式示意图为 。
(3)1 mol N2H4分子中含有的键数目为 。
(4)H2O2分子结构如图1,其中心原子杂化轨道为 ,估计它难溶于CS2,简要说明原因 。

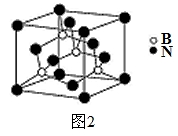
(5)氮化硼其晶胞如图2所示,则处于晶胞顶点上的原子的配位数为 ,若立方氮化硼的密度为g·cm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为________cm。
2013年初,雾霾天气多次肆虐我国中东部,该地区PM2.5严重超标。研究表明,PM2.5约60%来源于某些气体污染物在空气中转变而成的二次颗粒物。这些气体污染物主要有二氧化硫、氮氧化物、氨气、挥发性有机物。因此,控制、治理PM2.5污染源成为环保的重要课题。
(1)研究表明,TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,如图所示,OH与NO2的反应为NO2+OH HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是。
HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是。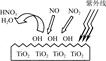
(2)如图所示的电解装置能吸收和转化NO2、NO和SO2。阴极排出的溶液中含S2O42-离子,能吸收NOx气体,生成的SO32-可在阴极区再生。请将S2O42-吸收NO2的离子方程式配平,并标明电子转移的方向和数目。
____S2O42-+____NO2+____OH- SO32-+____N2+____
SO32-+____N2+____
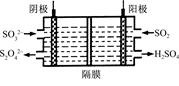
(3)已知上述电解装置阳极反应为:SO2-2e-+2H2O SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为。
SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为。
(4)PM2.5产生的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属等有毒物质。一般而言,粒径2.5微米至10微米的粗颗粒物主要来自扬尘等;2.5微米以下的细颗粒物(PM2.5)则主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物的排放等。请你结合信息,给出降低PM2.5排放的对策(至少两条): ______。
海洋是资源的宝库,海水中几乎存在所有的天然元素。海洋资源化学就是研究从海洋中提取化学物质的学科,除了研究从海洋中提取常量元素外,还研究从海洋中提取微量元素(浓度小于1mg/L)。
(1)海洋中含量最高的卤素元素在周期表中的位置为;与其同周期相邻且单质为固体的元素原子的核外电子排布式为。
(2)海洋中元素含量位于前列的元素有氧、氯、钠、镁、硫,其离子半径从大到小的顺序为(用离子符号表示),其中形成的化合物中能发生潮解的是(用电子式表示)。
(3)微量元素铍在海水中主要以Be(OH)+形式存在,其性质与铝元素相似,目前是从绿宝石(主要成分为铍铝硅酸盐Be3Al2Si6O18)中提取,由于铍是航空、电子、汽车等工业不可替代的战略金属材料,因此海水提铍会成为海洋资源化学新的研究方向。请写出:
①铍铝硅酸盐的氧化物形式的化学式:。
②Be(OH)+与强碱溶液反应的离子方程式:。
(4)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是(选填编号)。
a.海水提溴:海水浓缩
 溴蒸气
溴蒸气

 液溴
液溴
b.海水提镁:海滩贝壳
 石灰乳
石灰乳
 MgO
MgO 镁
镁
c.海带提碘:海带灼烧
 滤液
滤液 含碘有机溶液
含碘有机溶液 碘晶体
碘晶体
d.海盐提纯:海盐
 精盐
精盐
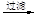 滤液
滤液
 食盐晶体
食盐晶体
铁是一种典型的过渡金属,铁和铁的化合物在生产和生活中有广泛的应用。完成下列计算:
(1)将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁。
①钢样中含铁________g。
②生成的CO2在标准状况下体积为________mL。
(2)向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤。洗涤沉淀,将洗涤液与滤液合并后稀释至250mL。取25mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50mL。计算原溶液中Fe3+的物质的量浓度。
(3)铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)]。将一块带锈铁片放入700mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020g铁。求:
①反应后溶液中溶质的成分与物质的量。
②原带锈铁片中铁锈的质量分数。
(4)用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示)。经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11:12。已知两种阳离子为Fe2+与Fe3+,物质的量之比为2:1。请通过计算确定X的化学式。
钯催化偶联反应可表示为:R-X + CH2=CH-R’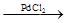 R-CH="CH-R’" + HX。美国化学家Richard F. Heck因研究此反应获2010年诺贝尔化学奖。以下是利用钯催化偶联反应合成一种香料A(
R-CH="CH-R’" + HX。美国化学家Richard F. Heck因研究此反应获2010年诺贝尔化学奖。以下是利用钯催化偶联反应合成一种香料A( )的流程:
)的流程:
完成下列填空:
(1)写出结构简式。B________________ E________________
(2)写出反应②的化学方程式______________________________________________。
(3)反应④属于____________(填反应类型)。反应⑤的条件是____________。
(4)为了促进反应⑥的进行,通常可以加入一种显_________的物质。
a. 强酸性 b. 弱酸性 c. 弱碱性 d. 强碱性
(5)写出A的两种符合下列条件的同分异构体的结构简式____________、___________。
i. 含有两个苯环(除苯环外不含其它环状结构);
ii. 只存在四种化学环境不同的氢原子。
(6)仅以B为有机原料,任选无机试剂,经过三步反应可得到一种含有六元环的酯。写出相关反应的化学方程式。
胡萝卜中含有大量的β-胡萝卜素,被人体吸收后可转化成视黄醇(即维生素A),是目前最安全补充维生素A的产品。在体内酶的催化下,1 mol β-胡萝卜素可氧化为2 mol视黄醛,然后再转化为视黄醇,其过程如下:
已知:
完成下列填空:
(1)β-胡萝卜素的化学式为_________________。反应I的类型为_________。
(2)β-胡萝卜素在人体吸收时需要相应的溶剂,下列适合作为溶剂的是________(选填编号);
a. 水 b. 油脂 c. 苯 d. 乙醇
许多保健品中都含有β-胡萝卜素,从其结构推测可能的作用是________(选填编号)。
a. 提供蛋白质 b. 补充微量元素 c. 抗氧化剂 d. 调节pH
(3)视黄醛的一种同分异构体属于萘( ,C10H8)的衍生物,其可能具有的化学性质有________(选填编号)。
,C10H8)的衍生物,其可能具有的化学性质有________(选填编号)。
a. 与溴水发生加成反应 b. 能与氯化铁溶液发生显色反应
c. 发生银镜反应d. 能使酸性高锰酸钾溶液褪色
(4)丁烯酮(CH2=CHCOCH3)是合成视黄醇和β-胡萝卜素的重要原料之一。工业上采用如下流程合成丁烯酮: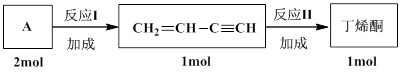
写出A的结构简式:__________。写出反应II的化学方程式:___________________。