含氮废水进入水体中对环境造成的污染越来越严重。某校环保小组的同学认为可以用金属铝将水中的NO3-还原成N2,从而消除氮污染。
(1)配平以下有关的离子反应方程式:
 NO3-+
NO3-+ Al+
Al+ H2O―→
H2O―→ N2↑+
N2↑+ Al(OH)3+
Al(OH)3+ OH-
OH-
(2)以上反应中失电子的物质是 ,每生成1 mol还原产物,将有 电子发生转移。
(3)现需除去1 m3含氮0.3 mol的废水中的NO3-(设氮元素都以NO3-的形式存在),则至少需要消耗金属铝的物质的量为
(4)该小组对某无色溶液所含离子进行分析,若溶液中只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、HCO3-、NO3-。已知该溶液可与Al2O3反应则:
①该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有________,一定不会含有大量的________。
②该溶液与Al2O3反应后有AlO2-生成,则原溶液中一定含有________,可能含有大量的________。
③写出该溶液与Al2O3反应生成AlO2-的离子方程式:___________________。
下图表示各物质之间的转化关系,已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。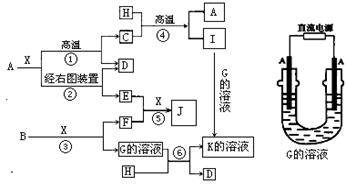
请按要求填空:
(1)写出物质的的化学式:D_______________,J_______________。
(2)写出反应④的化学方程式_________________________________________。
(3)写出通过上图实验生成E的电极反应式_______________________________。
(4)反应③中若转移1 mol电子,则生成F在标准状况下的体积为_____________。
(5)在上述①~⑥反应中,有水参加反应且水分子既不是氧化剂又不是还原剂的反应有_______。(填写序号)
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式__________________________。
(2)若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为。(溶液混合时体积变化忽略,下同)
(3)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol·L-1。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为___________(填“大于、等于、小于”或“均有可能”)。
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca。
(1)Ca的原子结构示意图。
(2)配平用钙线氧脱鳞的化学方程式:
P + FeO + CaO  Ca3(PO4)2 + Fe
Ca3(PO4)2 + Fe
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n。则金属M为_________,检测Mn+ 的方法是_____________________(用离子方程式表达)。
(4)取1.6g钙线试样,与水充分反应,生成224ml H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3g。
(5)处理炼钢厂含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:CO(g) + 1/2 O2(g) ="=" CO2(g) H = -283.0 kJ·mol-2
H = -283.0 kJ·mol-2
S(s) + O2(g) ="=" YO2(g) H = -296.0 kJ·mol-1
H = -296.0 kJ·mol-1
此反应的热化学方程式是 。
金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下图所示:
其中,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)当Al与稀硝酸反应时,稀硝酸表现的性质是
A.只表现强氧化性
B.只表现酸性
C.同时表现强氧化性及酸性
D.表现了强氧化性还表现了还原性
(2)在下列离子方程式的横线上填写产物的化学式(不需要配平)
Al + NO3-+ OH-+ H2O—→ +
(3)过量D的水溶液与A溶液反应的离子方程式是
(4)D—→C反应的化学方程式是
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质是
(6)除去C中的E气体杂质可用的化学方法是:(用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
(选修—有机化学基础)苯酚是重要的化工原料,通过下列流程可合成阿司匹林、冬青油和一些高分子化合物。已知:
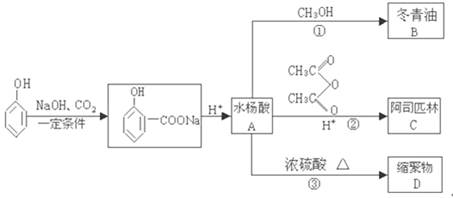
试按要求回答:
(1)由水杨酸A合成阿司匹林C的反应类型是。
(2)写出C、D的结构简式:C,D。
(3)写由水杨酸A合成冬青油B的化学方程式: 。
(4)水杨酸A易溶于冬青油中使产品不纯,用NaHCO3溶液反应后,经过操作得到较纯净的冬青油,写出A与NaHCO3溶液反应的化学方程式:。
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(写出一种试剂即可)。