【化学一物质结构与性质】(15分)周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R的基志原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子。请回答下列问题: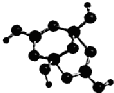
(1)写出Z的基态原子外围电子排布__________。
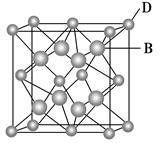
(2)R的某种钠盐晶体,其阴离子Am-(含R、W、氢三种元素)的球棍模型如上图所示:在Am-中,R原子轨道杂化类型有_______;m=_____。(填数字)
(3)经X射线探明,X与W形成化合物的晶体结构与NaCl的晶体结构相似,X2+的配位原子所构成的立体几何构型为____________。
(4)往Z的硫酸盐溶液中加入过量氨水,可生成[Z(NH3)4]SO4,下列说法正确的是_______。
| A.[Z(NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.在[Z(NH3)4]2+中Z2+给出孤对电子,NH3提供空轨道 |
| C.[Z(NH3)4]SO4组成元素中第一电离能最大的是氧元素 |
| D.SO42-与PO43-互为等电子体,空间构型均为四面体 |
(5)固体YCl5的结构实际上是YCl4+和YCl6-构成的离子晶体,其晶体结构与CsCl相似.若晶胞边长为apm,则晶胞的密度为____g•cm-3。(已知阿伏伽德罗常数为NA,用含a和NA的代数式表示)
硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI Ⅱ. 2HI H2+I2(g)
H2+I2(g)
Ⅲ. 2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如右图所示。那么,0~2 min内的平均反应速率:υ(HI)=。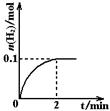
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则是原来的2倍。
a.压强b.HI的平衡浓度
c.达到平衡的时间d.平衡时H2的体积分数
(3)用足量Zn和一定量的硫酸制取H2,反应时溶液中水的电离
(H2O H++OH-)平衡移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的。
H++OH-)平衡移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的。
a.Na2CO3溶液b.K2SO4溶液 c.NaNO3溶液d.水e.CuSO4溶液
(4)以H2为燃料制成燃料电池,若:2H2(g)+O2(g)=2H2O(l) ΔH=-572 kJ/mol,
当电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为。
已知元素A、B、C、D和E的原子序数依次增大。A、B、C、D四种元素核电荷数均小于20,A、B同主族;B、C、D元素的基态原子具有相同的能层数,它们的基态原子中p能级上未成对电子数分别为1、3、1;E是周期表中(除放射性元素外)第一电离能最小的元素。回答下列问题:
(1)写出下列元素的符号:A 、E。
(2)C元素的价电子排布图为:;
该排布遵循的原理主要有:(答完整得分)。
(3)C、D元素形成的化合物主要有:(填化学式,答完整得分);其中相对分子质量较小的分子为分子(填“极性”或“非极性”),该分子的空间构型为,中心原子的杂化方式是。
(4)化合物BD3的熔点190℃、沸点182.7℃,那么BD3的晶体类型为;事实上,在BD3的化合物中往往以B2D6的形式存在,该形式的存在是由于形成的。(选填“氢键”、“范德华力”、“离子键”、“配位键”)
(5)下图为几种晶胞(或晶胞的1/8)示意图,其中 和
和 代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的(填序号),在该晶胞中阳离子的配位数为。
代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的(填序号),在该晶胞中阳离子的配位数为。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a |
|||||||||||||||||
| b |
c |
d |
|||||||||||||||
| e |
f |
||||||||||||||||
| g |
|||||||||||||||||
请回答下列问题:
(1)用电子式描述a~g中电负性最大和最小的元素形成化合物的过程:
。
(2)c的单质的结构式为:,已知互为等电子体的分子具有相似的价键结构,写出由上述元素组成与c的单质互为等电子体的电子式(任一种):。
(3)g元素在周期表中的位置是第四周期,族,该元素在周期表分区中属于区;写出g的基态原子的外围电子排布式:。
(4)分别由a、b、d、f元素形成的单质晶体的熔沸点由高到低顺序为(用单质的化学式表示):。
(5)写出由a、b、c、d元素组成,原子个数比为5∶1∶1∶3的化合物与足量烧碱溶液反应的离子方程式:。
已知下列两个热化学方程式:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH 1=-2 983.2 kJ/mol
②P(红磷,s)+O2(g)=P4O10(s) ΔH 2=-738.5 kJ/mol
(1)试写出白磷转化为红磷的热化学方程式:。
(2)相同的状况下,白磷与红磷能量较低的是:;白磷的稳定性比红磷:(填“高”或“低”)。
(3)已知键能数据,P-P:a kJ/mol;O=O:b kJ/mol;
P-O:c kJ/mol;P=O:d kJ/mol,破坏化学键要吸收能量,形成化学键要放出能量。参考如图物质结构,写出 a、b、c、d满足的关系式:。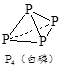
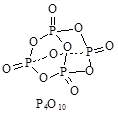
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素。,D跟B可形成离子化合物其晶胞结构如图。
请回答:
(1)A元素的名称是________;
(2)B的元素符号是________,C的元素符号是________,B与A形成的化合物比C与A形成的化合物沸点高,其原因是________________;
(3)E属元素周期表中第________周期,第________族的元素,其元素名称是________,它的+2价离子的电子排布式为________________;
(4)从图中可以看出,D跟B形成的离子化合物的化学式为________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________(只要求列出算式)。