为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g,以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)

(1)将仪器连接好以后,必须进行的第一步操作是_____________。
(2)此实验还必须用到的最重要的仪器是 ;仪器F的作用是 。
(3)已知仪器C中装有品红溶液,其作用是________ _ ___。
(4)实验室中备有以下常用试剂:
a.浓硫酸
b.酸性高锰酸钾溶液
c.品红溶液
d.饱和碳酸氢钠溶液
e.氢氧化钠溶液
f.碱石灰
g.无水硫酸铜
h.五氧化二磷
i.无水氯化钙
①请将下列容器中应盛放的试剂序号填入相应空格:B中______,D中______,E中______。
②实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是 。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”、“偏低”或“没影响”)。
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为__________。
(2014届浙江省杭州市杭州学军中学高三第二次月考化学试卷)
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 |
现象 |
| 取适量漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH |
pH试纸先变蓝,后褪色 |
 |
液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式 ;
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是 ;
②由实验a、b不能判断白雾中含有HC1,理由是 ;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 ;
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I- + 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 |
1 |
2 |
3 |
| KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
该漂白粉中有效成分的质量分数为 。
(2014届北京市东城区普通校高三3月联考理综化学试卷)
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。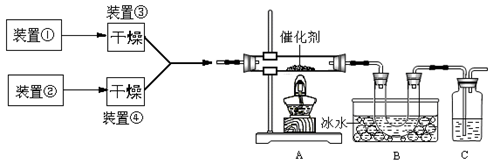
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。
(2014届四川省资阳市4月高考模拟考试理综化学试卷)
Ⅰ、某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3,乙同学认为沉淀是CuCO3和Cu(OH)2的混合物。他们设计实验通过测定沉淀中CuCO3的质量分数来确定沉淀的组成。
(1)按照甲同学的观点,发生反应的离子方程式为: 。
(2)两同学利用下图所示装置进行测定: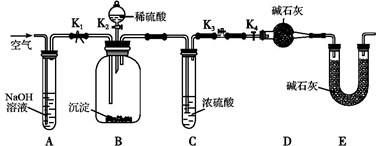
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为_____、_____、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K2、K4,打开K1、K3,通入过量空气
b.关闭K1、K3,打开K2、K4,充分反应
c.关闭K2、K3,打开K1、K4,通入过量空气
若沉淀质量为m,C中浓硫酸增重x,D中碱石灰增重为y,则CuCO3的质量分数为______。若未进行步骤a,将使测量结果 。
Ⅱ、某同学设计右图所示装置(夹持装置略,气密性已检验),用废铁屑来制取FeCl3·6H2O晶体。其操作步骤如下:
①打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸至过量。
②当……时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
③将烧杯中含有盐酸的溶液蒸发浓缩、冷却结晶、过滤后得到FeCl3·6H2O晶体。
请回答:
(1)步骤②中“……”的内容是_____。
(2)写出A中溶液进入烧杯后发生反应的离子方程式:____。
(3)步骤③烧杯中溶液里盐酸的作用是____。
某研究小组对“Br2和I2能否将Fe2+氧化为Fe3+”这一课题进行实验和探究。请你完成相关问题的回答。
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为 。
②乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是 。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
①为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKMnO4标准溶液装入50mL中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
牙膏中的摩擦剂一般由CaCO3、Al(OH)3或SiO2组成。某小组对几种牙膏中摩擦剂成分及其含量进行探究:
(1)根据上述信息,推测摩擦剂应具备的性质有
A.易溶于水 B.难溶于水 C.颗粒较大 D.颗粒较小
(2)已知A牌牙膏的摩擦剂是Al(OH)3,取少量牙膏样品,加水充分搅拌、过滤:
① 往滤渣中加入过量NaOH溶液,Al(OH)3与NaOH溶液反应的离子方程式____ __。
② 往①所得滤液先通入过量CO2,再加入过量稀盐酸,观察到的现象是 。
(3)已知B牌牙膏中摩擦剂可能含有一或两种物质,将此牙膏的摩擦剂溶于盐酸时,发现有不溶性物质。
① 对B品牌牙膏摩擦剂的成分提出合理假设:
假设1:只有SiO2假设2:可能有SiO2和CaCO3
假设3:可能有________________。
② 请设计方案对B品牌牙膏摩擦剂的成分进行验证。填写下表。限选试剂:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量牙膏样品,加水成分搅拌、过滤,得滤液A和沉淀B。 |
|
| 步骤2: |
|
| 步骤3: |
(4)已知C牌牙膏中的摩擦剂为CaCO3,为测定CaCO3的质量分数,取20.0g牙膏样品溶于水后过滤,将所得沉淀溶于100mL1mol/L的盐酸(假设所得溶液体积不变),从所得的溶液中取20.00mL,用1mol/L NaOH溶液进行滴定,消耗NaOH溶液5.00mL,则C品牌牙膏中CaCO3的质量分数为 _(保留四位有效数字)。.