“8.12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数 ( 25℃) |
Ki=1.77×10-4 |
Ki=5.0×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)NaCN溶液呈碱性的原因是 (用离子方程式表示)
(2)下列选项错误的是
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
(3)H2O2有有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-) c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验。将CN-的浓度为0.2000 mol/L的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②锥形瓶中充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
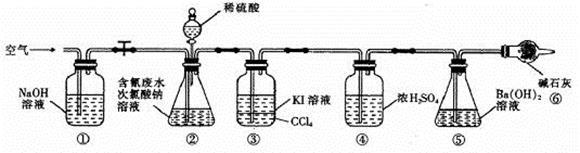
已知装置②中发生的主要反应依次为:
CN-+ ClO-=CNO-+ Cl-
2CNO-+2H+ + 3C1O-=N2↑+2CO2↑+ 3C1-+H2O
(5)①和⑥的作用是 。
(6)反应结束后,缓缓通入空气的目的是 。
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置 反应前后的质量(从装置①到⑥中选择,填装置序号)。
(本题共12分)绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品中的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9;SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
请回答下列问题:
(一)绿矾的制备
38.检验制得的绿矾中是否含有Fe3+的实验操作是。
39.操作II中,通入硫化氢至饱和的目的是;在溶液中用硫酸酸化至pH=2的目的是。
40.操作IV的顺序依次为:、冷却结晶、。
(二)绿矾中FeSO4·7H2O含量的测定
若用容量法测定绿矾中FeSO4·7H2O的含量。滴定反应是:5Fe2+ + MnO4—+8H+"5Fe3+ +Mn2++4H2O 。
实验方案如下:
① 称取15.041 g绿矾产品,溶解,在250mL容量瓶中定容。
② 量取25.00mL待测溶液于锥形瓶中。
③ 用0.0500mol/L KMnO4溶液(硫酸酸化)滴定至终点,记录初读数和末读数。
④。
⑤ 数据处理。
41.上述实验方案中的步骤④是。洁净的滴定管在滴定前必须进行的操作有:
① 检验活塞是否漏水;
②;
③ 向滴定管中加入KMnO4标准溶液到0刻度以上,赶走尖嘴部位的气泡,调节初读数。
(三)数据处理
某小组同学的实验数据记录如下:
| 实验次数 |
初读数(mL) |
末读数(mL) |
| 1 |
0.20 |
21.40 |
| 2 |
0.00 |
21.00 |
| 3 |
1.60 |
26.60 |
42.上述样品中FeSO4·7H2O的质量分数为(用小数表示,保留三位小数)。
(本题共12分)某化学小组的同学模拟工业制硝酸设计了如下图所示的装置。已知:
CaCl2+ nH2O→CaCl2·nH2O;CaCl2+ 8NH3→[Ca(NH3)8]Cl2
根据题意完成下列填空: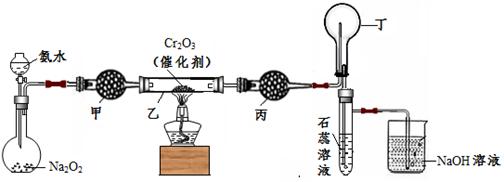
33.分液漏斗中氨水的浓度为9.0mol/L。现用质量分数为0.35、密度为0.88g/cm3的氨水配制9.0mol/L的氨水100mL,需要的定量仪器有(选填编号)。
a.100mL容量瓶 b.10mL量筒 c.50mL量筒 d.电子天平
34.受热时,乙中反应的化学方程式为。
35.实验开始先加热催化剂,当催化剂达红热时再打开分液漏斗活塞并移走酒精灯,可观察到的现象有。
36.干燥管甲的作用是;丙中盛放的药品为(选填下列编号),其目的是。
a.浓H2SO4 b.无水CaCl2 c.碱石灰 d.无水CuSO4
37.丁中除了NO之外,还可能存在的气体有(填写化学式)。烧杯中发生反应的化学方程式、。
(本题共12分)碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定。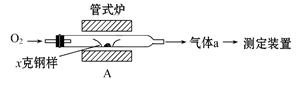
40.采用装置A,在高温下x克钢样中碳、硫转化为CO2、SO2。
①气体a的成分是____________。
②根据未配平的反应,______+5O2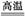 Fe3O4+3SO2,推测钢样中硫以_______形式存在(填写化学式)。
Fe3O4+3SO2,推测钢样中硫以_______形式存在(填写化学式)。
将气体a通入测硫装置中(如图),采用滴定法测定硫的含量。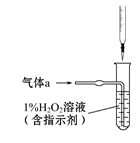
41.H2O2氧化SO2的化学方程式:_____________________________。
42.用NaOH溶液滴定生成的H2SO4,消耗zmL NaOH溶液,若消耗1 mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量数:________。
将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
43.推测气体a通过B和C的目的可能是_____________________。
44.计算钢样中碳的质量分数,应测量的数据是____________。
(本题共12分)某学习小组围绕氯气设计了系列实验。
34.用上图装置A制备氯气。选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:_______。实验过程中,使用分液漏斗滴加液体的操作是_____________________________________。
35.装置B中饱和食盐水的作用是____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 ____________。
36.为检验氯气是否具有漂白性,使氯气依次通过I、II、III三种物质,物质的顺序正确的是。
| A |
B |
C |
D |
|
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
37.为了进一步比较氧化性强弱,将一定量氯气通入溴化亚铁溶液后,再加入四氯化碳,振荡,静置,整个过程中肯定能观察到的现象是
A.水层显棕黄色 B.水层无色
C.四氯化碳层显红棕色D.四氯化碳层无色
38.查阅资料后小组发现,氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,排除环境方面的因素,可能的原因是:_______________________。
39.有人提出,工业上为防止污染空气,可用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:______________________。判断改用NaHCO3溶液是否可行:______(填“是”或“否”)。
某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6] 溶液,若产生红
褐色沉淀,证明有Cu2+。
(1)该同学假设黑色沉淀是CuO。检验过程如下:
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,未见红褐色沉淀。由该检验过程所得结论是_______________。
(2)再次假设,黑色沉淀是铜的硫化物。实验如下:
| 实验装置 |
现象 |
 |
1. A试管中黑色沉淀逐渐溶解 2. A试管内上方出现红棕色气体 3. B试管中出现白色沉淀 |
①现象2说明黑色沉淀具有______性。
②能确认黑色沉淀中含有S元素的现象是_________,相应的离子方程式是_____________。
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是___________________。
(3)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是_____________。