工业上可由天然气为原料制备甲醇,也可由水煤气合成甲醇。
(1)已知2CH4(g)+O2(g)=2CO2(g)+4H2(g) △H=akJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=bkJ/mol
试写出由CH4和O2制取甲烷的热化学方程式:___________________。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。图甲是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况。从反应开始到平衡,用CO表示平均反应速率v(CO)=____________,该反应的平衡常数表达式为______________。
CH3OH(g)。图甲是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况。从反应开始到平衡,用CO表示平均反应速率v(CO)=____________,该反应的平衡常数表达式为______________。
(3)在一容积可变的密闭容器中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示.
①下列说法不能判断该反应达到化学平衡状态的是___________。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA___________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=___________L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则电池负极反应的离子方程式为_____________。
②若电解质溶液中KOH的物质的量为1.0mol,当有0.75mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______________。
下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。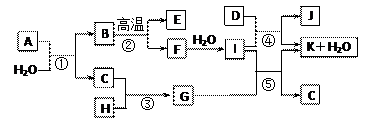
请回答下列问题:
⑴物质E的电子式是____________。
⑵反应⑤的化学方程式为___________________________________________。
⑶反应③的现象为___________________________________________。
⑷物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为________。
。
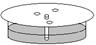
甲基橙和酚酞在水中和有机溶剂中的溶解度不同,当溶剂沿滤纸流经混合物点样时,甲基橙和酚酞会以不同的速率在滤纸上移动,从而达到分离的目的。某校化学兴趣小组拟通过该原理将甲基橙和酚酞从混合溶液A中分离开来:
步骤Ⅰ 把0.1 g甲基橙和0.1 g酚酞溶解在10mL60%的乙醇溶液里,配制混合溶液A;另将10mL乙醇和4mL浓氨水充分混合,配成混合溶液B;
步骤Ⅱ 在一张圆形滤纸中心扎一小孔,将细纸芯插入滤纸中央(如图)。在距滤纸中心约1cm的圆周上,选择三个点,分别用毛细管将A溶液在该三点处点样;
步骤Ⅲ 将滤纸覆盖在盛有B溶液的培养皿上,使滤纸芯与溶液接触,放置一段时间,点样逐渐向外扩散,形成黄环;
步骤Ⅳ 待黄环半径扩散到滤纸半径的二分之一时,取下滤纸,等滤纸稍干后,喷上饱和Na2CO3溶液,通过现象判断分离的效果。
试回答下列问题:
⑴本实验采用的分离方法叫_________,若分离淀粉胶体与氯化钠的混合液则可选用______法;
⑵步骤Ⅱ中若在滤纸上事先作点样位置标记,宜选用_____________笔(填“钢”或“铅”);
⑶步骤Ⅳ中喷洒Na2CO3溶液后,能观察到的现象是__________________________,这说明实验中________在滤纸上移动速率更快(填“甲基橙”或“酚酞”);
⑷他们可以通过_____________________________来判断分离的效果。
(1)为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使含硫化合物进入大气)反应的化学方程式:_________________________________。
(2)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式:NH3+HClO H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是。
H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是。
将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g) 2H2+O22CO+O2
2H2+O22CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是___________和___________,或___________和___________。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为n(O2)平=a mol,n(CO2)平=b mol。试求n(H2O)平="______" 。(用含a、b的代数式表示)
将等物质的量的A、B、C、D四种物质混合,发生如下反应:
aA+bB cC(s)+dD,当反应进行一定时间后,测得A减少了n mol,B减少了
cC(s)+dD,当反应进行一定时间后,测得A减少了n mol,B减少了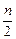 mol,C增加了
mol,C增加了 n mol,D增加了n mol,此时达到化学平衡。
n mol,D增加了n mol,此时达到化学平衡。
(1)该化学方程式各物质的化学计量数为a=__________、b=__________、c=__________、d=__________;
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:
A__________、B__________、D__________。
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为__________反应(填“放热”或“吸热”)。