A、B、C、D、E、F为原子序数依次增大的同 一短周期的主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,D元素原子次外层电子数是最外层电子数的2倍,E的气态氢化物的化学式为H2E。G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,请回答:
一短周期的主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,D元素原子次外层电子数是最外层电子数的2倍,E的气态氢化物的化学式为H2E。G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,请回答:
(1)写出E元素在元素周期表中的位置为
(2)D的原子结构示意图为
(3)用电子式表示出B、F形成化合物的电子式
(4)以上元素中原子半径最大的是 金属性最强的元素是 (均用元素名称回答)
(5)实验室制备G的氢化物的化学方程式:

(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1—2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是
②相应的化学方程式:
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为。
(3)NH3的沸点比PH3高,原因是;PO43-离子的立体构型为。
(4)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因。
(6)磷的一种单质白磷(P4)属于分子晶体,其晶胞结构如下图。已知最近两个白磷分子间的距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为 g/cm3(只要求列算式,不必计算)。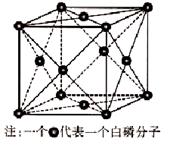
海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1) 海水中盐的开发利用:
Ⅰ.海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和_______池。
II.目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用____________________________________________。(写一点即可)
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如下图所示。请回答后面的问题: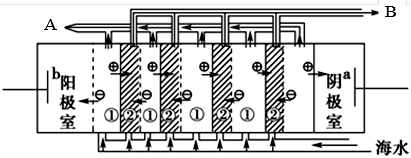
Ⅰ.海水不能直接通入到该装置中,理由是_____________________________________________。
Ⅱ. B口排出的是________(填“淡水”或“浓水”)。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下: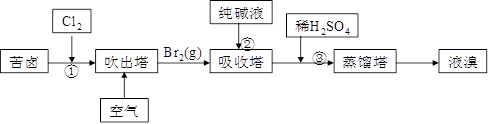
Ⅰ.若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为_____________
_________________________________________。
Ⅱ.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?_____________________________________________________________________。
Ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在900C左右进行蒸馏的原因是___________________________________________________________________________。
氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
(1)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g)△H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g) ΔH < 0
2N2(g)+3H2O(g) ΔH < 0
为提高氮氧化物的转化率可采取的措施是(写出1条即可)。
(3)利用ClO2氧化氮氧化物。其转化流程如下:
NO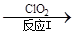 NO2
NO2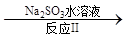 N2
N2
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O = NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
(4)利用CO催化还原氮氧化物也可以达到消除污染的目的。
已知质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图是反应2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H0 (填“>”、“<”或“无法确定”);催化剂表面积S1S2 (填“>”、“<”或“无法确定”)。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H0 (填“>”、“<”或“无法确定”);催化剂表面积S1S2 (填“>”、“<”或“无法确定”)。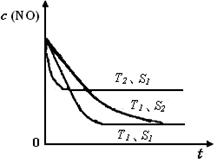
已知A、B、C、D、E、F六种短周期元素中,A、B、C、D是组成蛋白质的基本元素;A与B的原子序数之和等于C原子核内的质子数;A与E、D与F分别位于同一主族,且F原子核内的质子数是D原子核外电子数的2倍。据此,请回答:
(1)F在周期表中的位置是____________________________。
(2)由A、C、D、F按8:2:4:1原子个数比组成的化合物甲中含有的化学键类型为____________;甲溶液中各离子浓度由大到小的顺序为________________(用离子浓度符号表示)。
(3)化合物乙由A、C组成且相对分子质量为32;化合物丙由A、D组成且分子内电子总数与乙分子内电子总数相等;乙与丙的反应可用于火箭发射(反应产物不污染大气),则该反应的化学方程式为_________________________________________。
(4)由A、D、E、F组成的化合物丁能与硫酸反应并放出刺激性气味的气体,则丁的化学式为________;实验测得丁溶液显弱酸性,由此你能得出的结论是___________________。
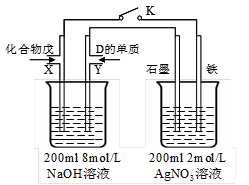
(5)由B、A按1:4原子个数比组成的化合物戊与D的常见气态单质及NaOH溶液构成原电池
|
(如图),试分析:
HPE是合成苯氧基丙酸类除草剂的重要中间体,其合成路线如下:
已知:① ②
②
据此回答下列问题:
(1)B中含有的官能团名称为,D的结构简式为。
(2)C + E F的反应类型为。
F的反应类型为。
(3)M的核磁共振氢谱中各吸收峰的面积之比为。
(4)写出G + M HPE的化学方程式。
HPE的化学方程式。
(5)X是G的同分异构体,其中满足以下条件的X共有种,写出其中一种X的结构简式 。
| A.苯环上有3个取代基且苯环上的一氯取代物有两种 |
| B.遇FeCl3溶液发生颜色反应 |
| C.X不能与NaHCO3反应产生CO2 |
| D.1 mol X最多能和3 mol NaOH反应 |