【物质结构与性质】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材 料。回答下列问题:
(1)基态铜原子的电子排布式为 ;已知高温下CuO—→Cu2O+O2,试从铜原子价层电子结构变化角度解释这一反应发生的原因: 。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ,若“Si-H”中键合电子偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为__ __。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3.NH3,BF3.NH3中B原子的杂化轨道类型为_______________,B与N之间形成 键。
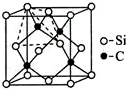
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为 ,在SiC中,每个C原子周围最近的C原子数目为 ,若晶胞的边长为a pm,则金刚砂的密度为 。
“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如图所示。
(1)下列关于M的说法正确的是______(填序号)。
a.属于芳香族化合物
b.遇FeCl3溶液显紫色
c.能使酸性高锰酸钾溶液褪色
d.1molM完全水解生成2mol醇
(2)肉桂酸是合成M的中间体,其一种合成路线如下:
已知:
①烃A的名称为______。步骤I中B的产率往往偏低,其原因是__________。
②步骤II反应的化学方程式为______________。
③步骤III的反应类型是________.
④肉桂酸的结构简式为__________________。
⑤C的同分异构体有多种,其中苯环上有一个甲基的酯类化合物有_____种。
科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为________________。
(2)下列关于CH4和CO2的说法正确的是_______(填序号)。
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2.
①基态Ni原子的电子排布式为_______,该元素位于元素周期表的第_____族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有___molσ键。
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
①“可燃冰”中分子间存在的2种作用力是________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是________。
“张-烯炔环异构反应”被《Name Reactions》收录。该反应可高效构筑五元环化合物:
(R、R‘、R“表示氢、烷基或芳基)
合成五元环有机化合物J的路线如下:
已知:
(1)A属于炔烃,其结构简式是 。
(2)B由碳、氢、氧三种元素组成,相对分子质量是30。B的结构简式是
(3)C、D含有与B相同的官能团,C是芳香族化合物,E中含有的官能团是
(4)F与试剂a反应生成G的化学方程式是 ;试剂b是 。
(5)M和N均为不饱和醇。M的结构简式是 。
(6)N为顺式结构,写出N和H生成I(顺式结构)的化学方程式: 。
C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第____周期第_____族。
(2)N的基态原子核外电子排布式为_____;Cu的基态原子最外层有___个电子。
(3)用“>”或“<”填空:
| 原子半径 |
电负性 |
熔点 |
沸点 |
| Al_____Si |
N____O |
金刚石_____晶体硅 |
CH4____SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____,溶液中的H+向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。
氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是 (选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是 。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是 。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g)△H=+177kJ/mol
ii.SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
①X代表的物理量是 。
②判断L1、L2的大小关系,并简述理由: 。