由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于刚才镀铝。工艺流程如下:
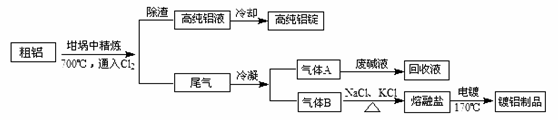
(注:NaCl熔点为801℃;AlCl3在181℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为① 和②
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有 ;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在
(3)在用废碱液处理A的过程中,所发生反应的例子方程式为 、______________。
(4)钢材镀铝后能防止钢材腐蚀,其原因是
(5)铝与过量NaOH溶液反应的离子方程式为________________________。反应后溶液中通入过量CO2,所发生反应的离子方程式为__________________________。
现有中学常见的三种单质甲、乙、丙,它们在一定条件下能发生如下变化,其中次要生成物已略去。
(1)已知乙元素的+2价离子与Ne原子具有相同的电子层结构,则②的离子方程式为____
____________________,④的化学方程式为________________________。
(2)若反应①可在常温下进行,则A的名称是_____________。若反应①需在加热条件下进行,则A的名称是_____________,反应的化学方程式为_____________________________。
(3)从C溶液中得到C需经过两步操作:先从C溶液中得到晶体,再将得到的晶体转化为C。从C溶液中得到晶体的过程被称为________________________,将得到的晶体转化为C的实验条件是______________________________________。
下列物质间在一定条件下可实现图中所示的一系列变化。其中固体W的焰色反应呈紫色,A是一切生物都不能缺少的气体。
请完成下列问题:
(1)判断X、Y各是什么物质:X________________________,Y________________________。
(2)写出有关反应的化学方程式:
①Z+H2SO4(浓) C:____________;
C:____________;
②W+H2SO4(浓) D+T:____________。
D+T:____________。
由H2和Cl2组成的混合气体,经光照充分反应后,通入到100 mL 1 mol·L-1的NaOH溶液中,图A表示溶液中某种离子的物质的量随着通入气体体积的变化而变化的曲线,图B表示溶液中的导电性随着通入气体体积的变化而变化的曲线。
(1)图A表示溶液中_____________________________离子的变化曲线,说明曲线下降的原因:____________________________________________________________________________。
(2)对溶液进行导电性实验,当通入的混合气体体积大于V1时,引起溶液导电性明显增强的主要阳离子是___________。
(3)当n="0.02" mol时,光照前的混合气体中H2和Cl2的物质的量之比为___________。
有A、B、C、D四种短周期元素(其单质也分别用A、B、C、D表示),四种元素的原子序数依B、D、C、A顺序增大。在一定条件下,B可以分别和A、C、D化合成甲、乙、丙等化合物,C和D化合可得丁。已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:
请填写下列空格:
(1)甲的浓溶液与一种黑色粉末共热可得A,其离子方程式为________________________。
(2)戊的结构式是________________________。
(3)丙+丁→D在一定条件下反应,是一种治理汽车尾气污染的好方法,该反应用化学方程式表示为________________________(条件从略)。
(4)A、B、C、D可构成一种化合物,其组成为AB4C4D,其化学式为____________。
在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如下图所示(已知气体的分压之比等于物质的量之比)。
(1)420 K时,发生反应的化学方程式为:________________________;若反应中消耗1 mol Xe,则转移电子___________mol。
(2)600—800 K时,会发生反应:XeF6(g) XeF4(g)+F2(g),其反应热ΔH________0(填“>”“<”或“=”)。理由是_______________________________。
XeF4(g)+F2(g),其反应热ΔH________0(填“>”“<”或“=”)。理由是_______________________________。
(3)900 K时,容器中存在的组分有__________________________。