过氧化钠、过氧化镁、过氧化氢都是重要的过氧化物。回答下列问题:
(1)过氧化镁不溶于水,但易溶于稀酸.广泛用作胃药,治疗胃酸过多.试写出过氧化镁与胃酸反应的离子方程式:___________________________________。
(2)高温下,过氧化钠在隔绝空气环境中可以将铁单质氧化成含FeO42-高铁酸盐,该反应的化学方程式为_________________________________。
(3)取少量含Fe2+、H+溶液于试管中,滴加几滴硫氰化钾溶液,无明显现象;再滴加H2O2,发现溶液变红色,其中包括的反应有________________________________________________
(写离子方程式);继续加H2O2,红色逐渐褪去且有气泡产生,反应原理为:
H2O2+SCN--→SO42-+CO2↑+N2↑+H2O+______(SCN-中S为-2价;将方程式补充完成并配平)
从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),试回答: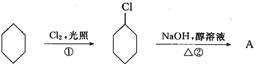
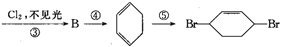
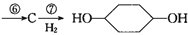
(1)化合物的结构简式:B ,C 。
(2)②的反应类型是 ;③的反应类型是 ;
(3)反应⑥所用试剂和条件是 。
(2014)不饱和酯类化合物在药物、涂料等领域应用广泛。
(1)下列关于化合物I的说法,正确的是
| A.与FeCl3溶液可能显紫色 |
| B.可能发生酯化反应和银镜反应 |
| C.能与溴发生取代和加成反应 |
| D.1mol化合物I最多与2molNaOH反应 |
(2)反应①的一种由烯烃直接制备不饱和酯的新方法
化合物II的分子式为 。1mol化合物II能与 molH2恰好反应生成饱和烃类化合物。
(3)化合物II可由芳香族化合物III或IV分别通过消去反应获得。但只有III能与Na反应产生H2。III的结构简式为 (写1种);由IV生成II的反应条件为 。
(4)聚合物
可用于制备涂料。其单体的结构简式为 。利用类似反应①的方法仅以乙烯为有机原料合成该单体,涉及的反应方程式为 。
白酒产品中的塑化剂主要源于塑料接酒桶、塑料输酒管、成品酒塑料内盖等。DBP是塑化剂的一种,可由下列路线合成:
已知以下信息: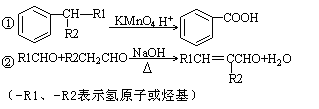
(1)A的结构简式是________,D的结构简式是________,D→E的反应类型是________。
(2)D和H2l:l反应生成E,则E官能团名称为________,DBP的分子式为________。
(3)由B和E以物质的量比1:2合成DBP的化学方程式为____________。
(4)写出同时符合下列条件的B的所有同分异构体的结构简式____________。
①能和NaHCO3溶液反应生成CO2
③能使FeCl3溶液发生显色反应
②能发生银镜反应
④苯环上含碳基团处于对位
(5)写出B与碳酸氢钠溶液反应的化学方程式________。
写出C生成D的反应的化学方程式_____ ___。
根据下列信息回答问题。
(1)请用系统命名法对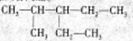 ,命名:_____________;
,命名:_____________;
(2)HO(CH2)3COOH发生缩聚反应后所得缩聚物的结构结构简式:____________;
(3)一定条件下某烃M与H2按物质的量之比1:2加成生成C2H5C(CH3)3,则烃M的结构简式为_____________.
I.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题: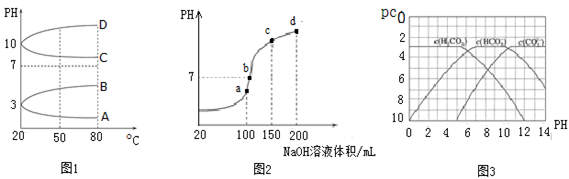
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)= mol·L-1(填数值)。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
II.pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH。如某溶液溶质的浓度为1×10-3 mol·L-1,则该溶液中该溶质的pC=-lg10-3=3。已知H2CO3溶液中存在下列平衡:CO2+H2O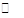 H2CO3 H2CO3
H2CO3 H2CO3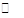 H++HCO3- HCO3-
H++HCO3- HCO3- H++CO32-
H++CO32-
图3为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图。请回答下列问题:
(1)在pH=9时,H2CO3溶液中浓度最大的含碳元素的离子为 。
(2)pH<4时,溶液中H2CO3的pC总是约等于3的原因是 。
(3)已知M2CO3为难溶物,则其Ksp的表达式为 ;现欲将某溶液中的M+以碳酸盐(Ksp=)的形式沉淀完全,则最后溶液中的CO32-的pC最大值为 (溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。