完成以下四个小题:
(1)请完成下列各空:
①pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH 7(填“>”或“<”);
(2)观察比较以上三个小题,试猜想证明某酸(HA)是弱电解质的原理有两个:
一是: ;
二是: 。
(3)请你根据以上原理提出一些方案,证明HA酸是弱电解质:(只需简明写出方案,不需写出具体步骤,以下项目可不填满也可增加项目)
①
②
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)氧元素能形成繁多的氧化物,请写出一个与CO2等电子的化合物。
(2)把Na2O、SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列。
(3)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为;
(4)Se原子基态核外电子的排布式为;H2Se的沸点:-41.1℃ ,H2S的沸点:-60.4℃,引起两者沸点差异的主要原因是;
(5)SO32-离子中硫原子的杂化方式,该离子的立体构型为;
(6)某金属元素A的氧化物用作玻璃、瓷器的颜料、脱硫剂。其立方晶体的晶胞结构如右图所示,
则该氧化物的化学式为。
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化: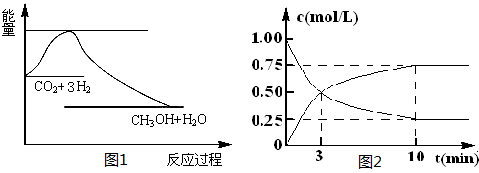
(1)关于该反应的下列说法中,正确的是(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) =;H2的转化率w(H2) =。
②该反应的平衡常数表达式K=。
③下列措施中能使化学平衡向正反应方向移动的是(填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有;其正极的电极反应式是:。
I.甲醇是一种可再生燃料,它的沸点为64.7oC。有科学家提出:把含有过量CO2的空气吹入碳酸钾溶液中,然后再把CO2从溶液中提取出来,经化学反应后得到甲醇,其构想流程如下: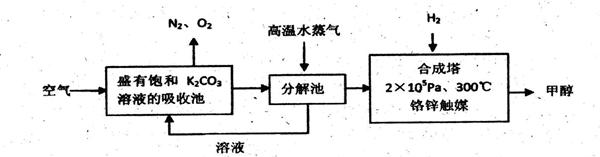
试回答下列问题:
(1)写出吸收池中主要反应的化学方程式。
(2)在2×105pa、300℃合成塔中,若有440gCO2与H2恰好完全反应生成甲醇和水,放出495kJ的热量,试写出合成塔中发生反应的热化学方程式。
(3)甲醇的一个重要作用是可以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:
。
Ⅱ.二氧化氯(C1O2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备C1O2的反应原理常采用:2NaC1O3+4HC1=2C1O2↑+C12↑+2H2O+2NaC1。若反应中产生0.1mo1C1O2,则转移电子的物质的量为________mol。
(2)目前已开发出用电解法制取C1O2的新工艺。
①下图示意用石墨做电极,在一定条件下 电解饱和食盐水制取C1O2。写出阳极产生C1O2的电极反应式:____。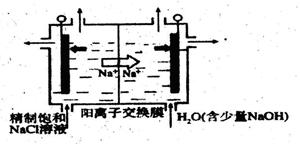
②电解一段时间.当阴极产生的气体体积为112mL(标准状况)时,停止电解。
通过阳离子交换膜的阳离子的物质的量为mol;用平衡移动原理解释阴极区pH增大的原因。
(3)C1O2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-,现用C1O2将CN-氧化,产物中有两种为气体,其离子反应方程式为。
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为____。元素B、C、D的第一电离能由大到小的排列顺序为。(用元素符号表示)
(2)D元素原子的最外层电子排布图为。DC42-的立体构型为____。
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的化学式为该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式。
合成氨工业对国防具有重要意义,如制硝酸、合成纤维以及染料等
(1)已知某些化学键的键能数据如下表:
| 化学键 |
N≡N |
H—H |
N—H |
| 键能kJ·mol-1 |
946 |
436 |
390 |
合成氨的热化学反应方程式为。
(2)常温下,向饱和NaCl与饱和氨水的混合溶液中通入过量CO2,有NaHCO3固体析出,该反应的化学方程式为;所得溶液中离子的电荷守恒式是;若向饱和NaCl与饱和CO2的混合溶液中通入氨气,则没有NaHCO3固体析出,原因是。
(3)氨氮废水(含NH3、NaOH和Na2SO4)超标排放会造成水体富营养化。右图通过直接电化学氧化法有效除去某工厂氨气。其中阴离子的流动方向为(填“向a极”或“向b极”),电解过程中,b极区的pH(填“增大”或“减小”或“不变”),阳极反应方程式为。