下列物质中属于强电解质的是: ,属于弱电解质的是 。
a.BaSO4
b.NaHCO3
c.H2SO3
d.Cu
e.Fe(OH)3
写出c、e两物质的电离方程式 。
常温下有浓度均为0.05mol/L的四种溶液:①Na2CO3②NaHCO3③HCl ④NH3·H2O,回答相关问题:
(1)上述溶液中,可发生水解的是(填序号)
(2)上述溶液中,既能与NaOH溶液反应,又能与H2SO4溶液反应的溶液中,离子浓度大小的关系
(3)向④中加入少量NH4Cl固体,此时c(NH4+/OH-)的值(“增大”、“减小”或“不变” )
(4)若将③和④的溶液混合后,溶液恰好呈中性,则混合前③的体积④的体积(“大于”、“小于”或“等于” )
(5)取10mL的③溶液,加水稀释到500mL,则此溶液中由水电离出的c(H+)=________mol/L
请完成下列各空:
(1) pH= a的CH3COOH溶液稀释100倍后所得溶液pHa +2(填“>”或“<” 下同)
(2)0.01 mol·L-1CH3COOH溶液的pH2
(3)0.1 mol·L-1CH3COONa溶液的pH7
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题。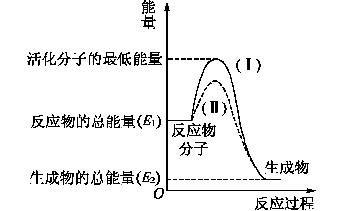
(1)图中所示的反应是__________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要” )加热,该反应的ΔH=________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为__________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因___________。
已知有以下物质相互转化
试回答:
⑴写出各物质的化学式ABCD
⑵向G溶液中滴加KSCN的实验现象是
⑶向G溶液加入A的有关离子反应方程式
(4)写出E到F的化学方程式:
下图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线,试回答:
(1) A点时已参加反应的AlCl3和NaOH的物质的量之比是
(2) OA段曲线所表示的反应的离子方程式是
(3) AB段曲线所表示的反应的离子方程式是
(4) B处溶液中存在的浓度最大的离子是(填离子符号)。向B处于生成的溶液中通入CO2,可见到的现象是