氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g) 2H2(g)+O2(g)△H = +484kJ·mol—1,不同时段产生O2的量见下表:
2H2(g)+O2(g)△H = +484kJ·mol—1,不同时段产生O2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
上述反应过程中能量转化形式为光能转化为 能,达平衡过程中至少需要吸收光能为 kJ。
(2)现有反应:CO(g)+ H2O(g)  CO2(g)+ H2(g) △H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO2(g)+ H2(g) △H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| 物质的量 |
CO |
H2 O |
CO2 |
H2 |
| 甲 |
a mol |
a mol |
0 mol |
0 mol |
| 乙 |
0mol |
0 mol |
2a mol |
a mol |
| 丙 |
0 mol |
0 mol |
a mol |
a mol |
| 丁 |
a mol |
a mol |
a mol |
a mol |
上述四种情况达到平衡后,甲、乙、丙、丁容器中n(CO)的大小顺序为 。
(3)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3得金属钨,总反应为WO3 (s) + 3H2 (g) W (s) + 3H2O (g)。请回答下列问题:
W (s) + 3H2O (g)。请回答下列问题:
①某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为 。
②上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 |
25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 |
WO3 W2O5 WO2 W |
假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
③钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) WI4 (g)。下列说法正确的有 (填字母)。
WI4 (g)。下列说法正确的有 (填字母)。
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
【化学-物质结构与性质】
N和B元素在化学中有很重要的地位。
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为___________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其原因是_____________________________________________,其中BF3的分子构型为__________。
(3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(4)NaN3是抗禽流感药物“达菲”合成过程中的中间活性物质,NaN 3也可用于汽
车的保护气囊。3 mol NaN 3受撞击会生成4 mol N2气体和一种离子化合物A。
①请写出上述NaN 3撞击反应的化学方程式。
②根据电子云的重叠方式判断:N2分子中存在的σ键和π键数目之比为:。
某短周期元素原子最外层电子数为次外层的2倍,其单质甲可发生:
甲+乙 丙+丁+水。
丙+丁+水。
(1)若丙为NO2。①甲与乙反应的化学方程式为。
② NO2可作火箭重要燃料—肼(N2H4)的助燃剂。N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1,2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=—1135.7 kJ·mol-1,写出肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:。
(2)若丙为SO2。①把乙滴入硫酸铜晶体,观察到的现象是。
②完成SO2使KMnO4褪色的离子方程式:MnO4- +SO2 +=Mn2+
+SO42- +H+
③一定条件下:2SO2(g)+O2(g)  2SO3(g) △H<0。反应的平衡常数表达式K=;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是
2SO3(g) △H<0。反应的平衡常数表达式K=;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是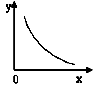
a.x表示温度,y表示n(SO2) b.x表示压强,y表示SO2的转化率
c.x表示n(SO2),y表示n(O2) d.x表示n(SO3),y表示化学平衡常数K
(13分)硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为: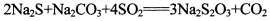 o
o
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_______。
(2)用该方法获得的Naj2O3^H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】
假设1 :晶体中只含>fe2C03杂质
假设2:晶体中只含Na2S杂质
假设3: ____________________________
【查阅资料】
②NhS2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应: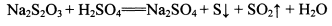
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:____________________________
【设计方案进行实验】
基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂: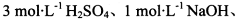 酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3)已知: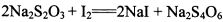 。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用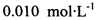 的碘水进行多次取样滴定,测得
的碘水进行多次取样滴定,测得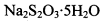 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
(14分)在氯化银的表面负载银纳米颗粒后将具有优秀的光催化性能,可用于光催化降解污水中的有机污染物。某课题组利用如下流程制备这种光催化剂,并同时获取新型净水剂高铁酸钠。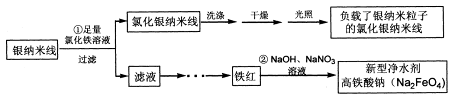
(1)写出①反应的离子方程式______________
(2) 过滤得到氯化银纳米线须洗涤干净后再进行光照。检验氯化银纳米线是否洗净的操作方法是____________________________
(3) 反应②的离子方程式是
(4) 由21.60g银纳米线得到了25.15g最终产物,则产物中银纳米粒子的质量分数是_______。(计算结果保留两位小数)
(17分)卡托普利OE)是用于治疗各种原发性高血压的常用药物,可由下列路线合成: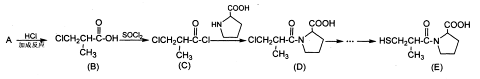
(1) A的结构简式是_______, B中含有官能团的名称是_______。
(2) C→D的反应类型是_______
(3) 已知: (高分子化合物),则
(高分子化合物),则
B→F的化学方程式为____________________________;
高分子化合物H的结构简式为_____________________。
(4) D的消去产物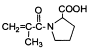 有多种同分异构体,如
有多种同分异构体,如 等。写出其中满足下列条件的同分异构体:
等。写出其中满足下列条件的同分异构体:
(i) 含有苯环,不含甲基
(ii) 能与NaOH溶液以物质的量之比1:1完全中和
(iii) 苯环上一卤代物只有一种
___________________________________、____________________________
(5) 下列关于卡托普利(¾的说法正确的是_______。
a.能发生取代反应 b.在氧气中充分燃烧的产物有SO2
c.能与Na反应生成氢气 d. E的分子式为