铁及其化合物在生产、生活中有广泛应用,请回答下列问题:
(一)高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 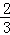 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数 如下:
温度/℃ 1000 1115 1300
平衡常数 4.0 3.7 3.5
(1)该反应的平衡常数表达式K= ;△H 0(填“>”、“<”或“=”).
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是 .
| A.提高反应温度 | B.移出部分CO2 |
| C.加入合适的催化剂 | D.减小容器的容积 |
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正 υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)= .
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是 ;生成0.5mol K2FeO4转移电子的物质的量是 mol.
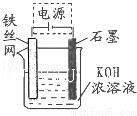
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示.电解过程中阳极的电极反应式为 .
水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH) 、Pb(OH)
、Pb(OH)  ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
,各形态的浓度分数α随溶液pH变化的关系如下图所示: 
(1)Pb(NO3)2溶液中, ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, 增加,可能的原因是________________________________。
增加,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有__________,pH=9时主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离 子 |
Pb2+ |
Ca2+ |
Fe3+ |
Mn2+ |
Cl- |
| 处理前浓度/(mg·L-1) |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
| 处理后浓度/(mg·L-1) |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是________。
(4)如果该脱铅剂(用EH表示)脱铅过要发生的反应程中主为:2EH(s)+Pb2+ E2Pb(s)+2H+则脱铅的最合适pH范围为( )
E2Pb(s)+2H+则脱铅的最合适pH范围为( )
A.4~5B.6~7 C.9~10D.11~12
有甲、乙、丙三种物质: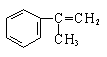


甲乙丙
(1)乙中含有的官能团的名称为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):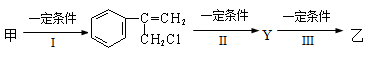
其中反应I的反应类型是_________,反应II的条件是_______________,反应III的化学方程式为__________________________________(不需注明反应条件)。
(3)由甲出发合成丙的路线之一如下:
(a)下列物质不能与B反应的是(选填序号)。
a.金属钠 b.FeCl3 c.碳酸钠溶液 d.HBr
(b)C的结构简式为___________;丙的结构简式为。
(c)D符合下列条件的所有同分异构体种,任写其中一种能同时满足下列条件的异构体结构简式。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应
A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)相同温度下,当A1、B1的物质的量浓度相等时,两种溶液中水电离出的氢离子的物质的量浓度之比为________。
(3)0.1mol・L-1NaNO2溶液中离子浓度由大到小的顺序为___________________________________。
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是___________。
(5)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________。
已知有以下物质相互转化
焰色反应显紫色,说明D溶液中含有K元素。又因为D能和硝酸银溶液反应生成白色沉淀氯化银,所以D应该是氯化钾。EF的转化以及沉淀颜色可知,E是氢氧化亚铁、F是氢氧化铁,G则氯化铁。B和C反应生成氯化钾和氢氧化亚铁,所以BC是氢氧化钾和氯化亚铁。G能和A反应生成B,所以A是铁,B是氯化亚铁,C是氢氧化钾,气体是氢气。
试回答:试回答:(1)写出E的化学式,H的化学式。
(2)写出由E转变成F的化学方程式。
(3)检验G溶液中的金属阳离子的方法是:;
向G溶液加入A的有关离子反应方程式。
(4)写出A在一定条件下与水反应的化学方程式。
有下列6种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3组成一个氧化还原反应,请回答下列问题:
(1)将这6种物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
________+Na2SO3+________→________+________+________+H2O
(2)反应物中发生氧化反应的物质是_________(填化学式),被还原的元素是_______。
(3)反应中1mol氧化剂_______(填“得到”或“失去”)________mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
□__________ +□__________ +□__________ →