三乙酸甘油酯是一种优良的溶剂、定香剂和增塑剂。实验室制备三乙酸甘油酯的反应原理、实验装置及相关数据如下:
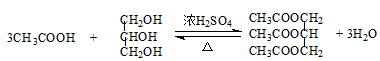
 |
物质 |
相对 分子质量 |
密度/g·cm-3 |
沸点/℃ |
水中 溶解性 |
| 甘油 |
92 |
1.2636 |
290 (分解) |
溶 |
|
| 乙酸 |
60 |
1.0492 |
118 |
溶 |
|
| 三乙酸甘油酯 |
218 |
1.1596 |
258 |
不溶 |
实验步骤:
步骤1.在500mL反应器中加入200g冰醋酸,92g甘油和100mL苯,开动搅拌器,慢慢从插温度计口加入3mL浓硫酸后,缓缓加热并回流1h,停止加热。
步骤2.用5%碳酸钠溶液洗涤,再用水洗涤,最后加入无水氯化钙。
步骤3.先进行常压蒸馏收集75~85℃馏分。
步骤4.将常压馏分再进行减压蒸馏,收集128~131℃/933Pa馏分,最终得产品176g。
(1)步骤1先开搅拌器后加浓硫酸的目的是 ;冰醋酸过量的目的是 。
(2)用5%碳酸钠溶液洗涤的主要目的是 ;加无水氯化钙的目的是 。
(3)最后用减压蒸馏而不用常压蒸馏其原因是 。
(4)本次实验产率为 。
Ⅰ、某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其设计的依据是;但该装置存在缺陷,请指出。
(2)乙同学设计了如图2装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。乙同学可能观察到的现象A.;B.;C.。从环保角度考虑,该装置有明显不足,请指出提出改进建议。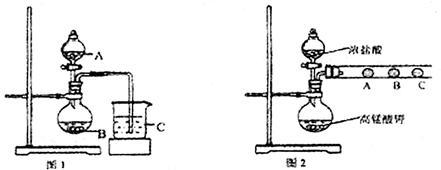
Ⅱ、另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:
电解时,粗铜应与电源的极相连。阴极上的电极反应式为。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式:
。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
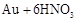  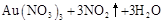 |
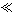 1 1 |
| 2 |
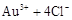  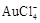 |
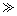 1 1 |
请根据以上信息简要解释溶解阳极泥能够溶于王水的原因
。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程。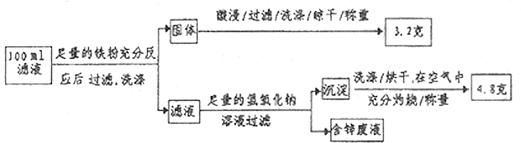
则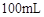 滤液中
滤液中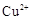 的浓度为
的浓度为 ,
,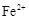 的浓度为
的浓度为 。
。
用下图装置进行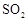 转化为
转化为 的转化率测定实验:
的转化率测定实验: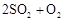
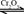
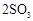
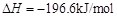 。已知:
。已知:
熔点(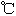 ) ) |
沸点(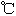 ) ) |
|
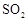 |
-72.4 |
-10 |
 |
16.8 |
44.3 |

(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接合适的装置(可重复使用),请从下列A~E中选择适宜的装置,将其序号填入空格内。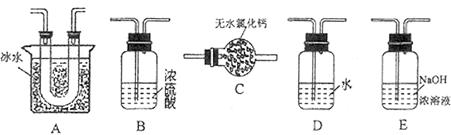
(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程)。
(3)实验时,浓硫酸有顺利滴入烧瓶中,甲装置所起作用的原理是
。
(4)开始实验时,先从乙处均匀通入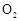 ,为使
,为使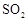 有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是。
有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是。
(5)实验中“当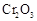 表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是;若用大火加热有
表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是;若用大火加热有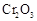 处的反应管时,
处的反应管时,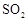 的转化率会(填“升高”、“降低”或“不变”)。
的转化率会(填“升高”、“降低”或“不变”)。
(6)实验时若用25.2g的 ,加入的浓硫酸是足量的,反应结束时继续通入
,加入的浓硫酸是足量的,反应结束时继续通入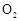 一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中
一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中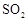 的转化率为%(保留小数点后一位)。
的转化率为%(保留小数点后一位)。
“84消毒液”与硫酸溶液反应可以制取氯气,反应方程式为:
NaClO + NaCl + H2SO4  Na2SO4+ Cl2↑+ H2O。为探究氯气的性质,某同学设计了如下所示的实验装置
Na2SO4+ Cl2↑+ H2O。为探究氯气的性质,某同学设计了如下所示的实验装置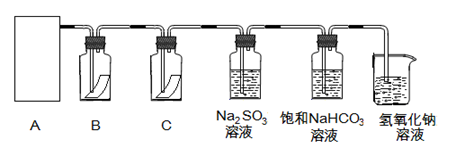
请回答:(1)从①、②、③装置中选择合适的制气装置(A处)(填写序号)。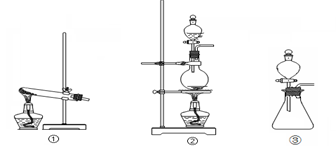
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是,说明该装置存在明显的缺陷,请提出合理的改进的方法。
(3)为了验证氯气的氧化性,将氯气通Na2SO3溶液中,写出氯气与Na2SO3溶液反应的离子方程式。
(4)写出氯气与氢氧化钠溶液反应的化学方程式,为验证尾气吸收后的溶液中存在氯离子,正确的操作为。
(5)已知RCH2COOH和Cl2在红磷存在时发生取代反应生成RCHClCOOH。现有分子式为C4H8O2的羧酸A,发生如下变化。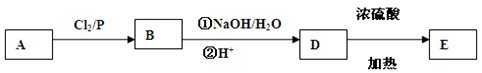
E的分子式为C8H12O4,E的核磁共振氢谱显示只有一个峰。写出E的结构简式。
氮化硅的强度很高,尤其是热压氮化硅,是世界上最坚硬的物质之一,氮化硅陶瓷可做燃气轮机的燃烧室、机械密封环、输送铝液的电磁泵的管道及阀门、永久性模具、钢水分离环等。制备氮化硅可将硅粉放在氮气中加热至1000℃左右直接氮化制得,实验室制备氮化硅装置示意图如下: 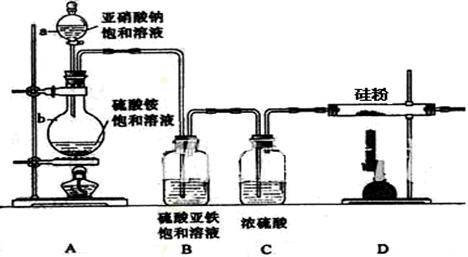
回答下列问题:
(1)检查装置气密性的方法是
,a仪器的名称是
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式;
(3)装置B的作用是,装置C的作用是;
(4)已知氮化硅的化学性质稳定,但常温下易溶于
氢氟酸溶液生成一种白色的胶状沉淀和一种盐,请写
出此化学反应方程式:;
(5)实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和
表中提供的物质完成相关实验,最合理的选项是()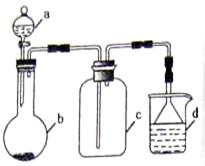
| 选项 |
a物质 |
b物质 |
c收集的气体 |
d中的物质 |
| A |
浓氨水 |
NaOH |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
澄清石灰水 |
| C |
稀硝酸 |
Fe |
NO2 |
H2O |
| D |
浓盐酸 |
KMnO4 |
Cl2 |
NaOH溶液 |
为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是。
(2)棉花中浸润的溶液为。
(3)A中发生反应的化学方程式为。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是(填“甲”“乙”“丙”)。
| 过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
|
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+ SO32- (aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
某同学设计如下实验,证实该假设成立:
①溶液E和F分别为、。
②请用化学平衡原理解释步骤3中溶液由红棕色变为浅绿色的原因。