在氢氟酸溶液中,存在如下电离平衡:HF H++F﹣
H++F﹣
(1)加入固体NaOH,电离平衡向 反应方向移动,c(H+) .
(2)加入固体NaF,电离平衡向 反应方向移动,c(H+) .
(3)升高温度,电离平衡向 反应方向移动,c(H+) .
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为mol·L-1·s-1反应的平衡常数K1为。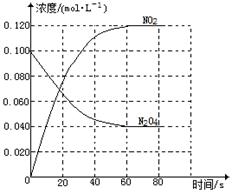
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是。
②列式计算温度T时反应的平衡常数K2。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是。
(8分)已知下列热化学方程式:
①H2(g)+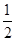 O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
②H2(g)+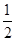 O2(g)===H2O(g)ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g)ΔH=-241.8 kJ·mol-1
③C(s)+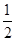 O2(g)===CO(g)ΔH=-110.5 kJ·mol-1
O2(g)===CO(g)ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)===CO2(g)ΔH=-393.5 kJ·mol-1
回答下列各问题:
(1)上述反应中属于放热反应的是_______________________________________。
(2)H2的燃烧热为________;C的燃烧热为________。
(3)燃烧10 g H2生成液态水,放出的热量为________。
(4)CO的燃烧热为________;其热化学方程式为______________。
把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+ O2(g)=====CO2(g);ΔH1<0 ①
途径Ⅱ先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g);ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)=====2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=====2H2O(g);ΔH4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量_________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________。
已知H2 ( g ) + 1/2O2 ( g ) = 2H2O ( g ),反应过程中能量变化如下图:请回答下列问题: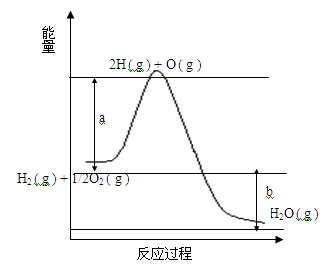
(1)图中a,b分别代表什么意义?a.;b.。
(2)该反应是反应(填“吸热”或“放热”),△H(填“< 0”或“> 0”)。
下表中是一些化学键键能的数据
| 化学键 |
Cl-Cl |
Br-Br |
I-I |
H-Cl |
H-Br |
H-I |
H-H |
| 键能(kJ/mol) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
根据上述数据回答(1)~(3)题
(1)下列物质本身具有的能量最低的是
A.H2B.Cl2 C.Br2 D.I2
(2)X2 + H2 = 2HX(X代表卤族原子)的反应是反应(填“吸热”或“放热”)
(3)相同条件下,等物质的量的X2(卤素单质)分别与足量的氢气反应,放出或吸收的热量最多的是。