下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。请根据此表,结合中学学过的化学知识,回答下列问题:
| 配料表 |
精制海盐、碘酸钾(KIO3) |
| 含碘量 |
20―40mg/kg |
| 储藏方法 |
密封避光、防潮 |
| 食用方法 |
烹调时待食品熟后加入碘盐 |
(1)据物质分类中的树状分类法有关知识,在① HIO3 ② 碘酸钠(NaIO3) ③ KOH ④ I2O5 ⑤ NaCl五种 (填“混合物”或“化合物”或“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的有
____ _________(填序号)。
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾(KIO3) 溶于水(填“能”或“不能”),化学性质:碘酸钾(KIO3)在受热时 。
下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。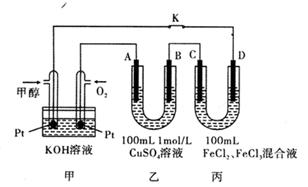
(1)甲中负极的电极反应式为____。
(2)乙中A极析出的气体在标准状况下的体积为____。
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系右图,则图中②线表示的是离子的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要mL 5.0 mol/L NaOH溶液。
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NCOONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡气体总浓度(×10—3 mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①氨基甲酸铵分解反应的焓变△H 0(填“>”、“<”或“=”)。
②可以判断该分解反应已经达到化学平衡的是____。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25.0℃时的分解平衡常数为。
(2)25℃时,NH3.H2O电离常数Kb=1.8×10—5,Mg(OH)2的溶度积常数Ksp=1.8×10—11,用pH计测得0.5 mol/L氨水溶液的pH约为。在某氯化镁溶液中加入一定量的某浓度的烧碱后,测得混合液pH =11.0,则此温度下残留在溶液中的c(Mg2+)=____。(已知lg2≈0.3、lg3≈0.5)。
某研究性学习小组利用下列原料和流程制备CuSO4·5H2O。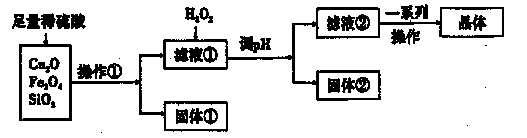
已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+。
(1)操作①的名称为____。,
(2)若固体①的成分为混合物,则其成分的化学式为____。
(3)将H2O2加入滤液①中,发生反应的离子方程式为。
(4)调pH可选用的药品为____。
| A.NaOH溶液 | B.CuO | C.氨水 | D.CuCO3 |
(5)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是。
如图为部分短周期元素化合价与原子序数的关系图。请回答下列问题。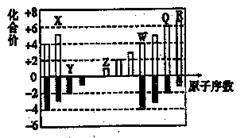
(1)元素Q位于周期表中第周期______族。
(2)将X、Z、Q、R四种元素的氢化物各1mol和水混合后,分剜得到l L溶液,所得水溶液碱性最强的氢化物的电子式是。
(3)Z的最高价氧化物对应的水化物与W的单质反应的化学方程式为。
(4)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。RY2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50 g RY2时,共转移了1 mol电子。则反应的离子方程式是____。
阿明洛芬属于苯丙酸类抗炎药,镇痛效果优于布洛芬。下图是阿明洛芬的一条合成路线。
(1)反应①为取代反应,该步反应物Me2SO4中的“Me”表示,D中官能团的名称是。
(2)写出E的结构简式:。
(3)G能发生的反应类型是(填字母序号)
| A.取代反应 | B.酯化反应 | C.加聚反应 | D.还原反应 E.加成反应 |
(4)写出F在NaOH溶液中反应的化学方程式:。
(5)写出所有满足下列条件的B的同分异构体:。
①只含有一个环(既苯环)的芳香族化合物;②核磁共振氢谱中氢峰的个数相比B的其它同分异构体最少。