某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是 (填字母)。
A. Ca(OH)2 B. Na2CO3 C. CaCl2 D. NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g) 2NO(g) ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
2NO(g) ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g) 2C(s)+O2(g)。已知该反应的ΔH>0,简述该设想能否实现的依据 。
2C(s)+O2(g)。已知该反应的ΔH>0,简述该设想能否实现的依据 。
实验室需要0.1 mol/L NaOH溶液450 mL和0.5mol/L硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是(填字号),配制上述溶液还需用到的玻璃仪器是(填仪器名称)。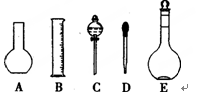
(2)下列操作中,是容量瓶所具备的功能有。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.配制任意浓度和体积的标准溶液 D.稀释某一浓度的溶液 E.量取一定体积的液体
(3)根据计算用托盘天平称取NaOH的质量为g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度(填“大于”“等于”或“小于”)0.1 mol/L。若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作:。
(4)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为ml。如果实验室有10 mL,15 mL,20 mL量筒,应选用mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是。
(5)下列操作会使配制的NaOH溶液浓度偏低的是。
A.用滤纸称量NaOHB.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.整个配制过程中,容量瓶不振荡
1.52g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是。
(2)NO2和N2O4的混合气体中,NO2的体积分数是。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是mL。
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝。上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为,下列可作阴极材料的是__________。
A.铝材 B.石墨 C.铅板 D.纯铝
(2)阳极氧化能使金属表面生成致密的氧化膜,装置如下图所示。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。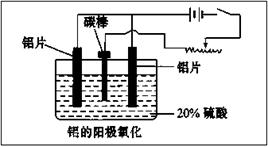
(3)下列说法正确的是。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是____________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:__________________;负极的电极反应式:_______________。
(3)下图是一个电解过程示意图。
①锌片上发生的电极反应式是:_____________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)写出下列元素的元素名称:A________,B________,C________,D________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是________。
(3)A与B形成的三原子分子的电子式是________,B与D形成的原子个数比为1∶1的化合物的电子式是________。
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是______________________。