某化学课外小组用右图装置制取溴苯,先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
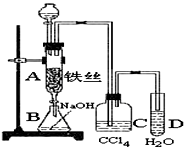
(1)写出A中反应的化学方程式
(2)实验结束时,打开A下端的活塞,让反应液流入B中, 充分振荡,目的是 。
(3) C中盛放CCl4的作用是 。
(4)为证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入 ,现象是 ,则能证明该反应为取代反应。另一种验证的方法是向D中加入 ,现象是 。
某高二化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果如下:试根据上表中的实验现象回答下列问题:
| 编号 |
电极材料 |
电解质 溶液 |
电流计指针偏转方向 |
| 1 |
Mg、Al |
稀盐酸 |
偏向Al |
| 2 |
Al、Cu |
稀盐酸 |
偏向Cu |
| 3 |
Al、石墨 |
稀盐酸 |
偏向石墨 |
| 4 |
Mg、Al |
NaOH |
偏向Mg |
| 5 |
Al、Zn |
浓硝酸 |
偏向Al |
⑴实验1、2中 Al所作的电极是否相同?
⑵写出实验3中的电极反应式和电池总反应方程式。
⑶实验4中 Al做正极还是做负极,为什么?写出Al电极的电极反应式。
⑷解释实验5中电流计指针偏向Al的原因?
⑸根据实验结果总结:在原电池中金属铝作正极还是作负极受到哪些因素的影响。
经分析知,某工厂的废水中含有Zn2+、Cu2+、Hg2+、Fe3+离子,请你设计一个回收并分别得到Cu和Hg的实验方案。(要求:写出简明的操作步骤和有关的离子方程式)
某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在下图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值 (填偏高、偏低或不变);
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
| 实验序号 |
起始温度t1/℃ |
终止温度(t2)℃ |
温差(t2-t1)℃ |
||
| 盐酸 |
NaOH溶液 |
平均值 |
|||
| 1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
| 2 |
25.1 |
25.1 |
25.1 |
31.8 |
6.7 |
| 3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18J(g.·℃)则该反应的中和热为△H=___________________________________;
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会 (填偏高、偏低或不变),其原因是 ;
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,试分析此操作步骤对实验测定中和热的影响 。
某种催化剂为铁的氧化物。化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加
溶液后出现红色。一位同学由此得出该催化剂中铁元素价态为+3的结论。
(1)请指出该结论是否合理并说明理由。
(2)请完成对铁元素价态的探究:
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:3
、3%
、6
、0.01
、
稀溶液、0.1
、20%
、蒸馏水。
①提出合理假设:
假设1:;
假设2:;
假设3:。
②设计实验方案证明你的假设(不要在答题卡上作答)。
③实验过程:
根据②的实验方案,进行实验。请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 |
预期现象与结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
|
| … |
某探究小组用
与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用
浓度为1.00
·
、2.00
·
,大理石有细颗粒与粗颗粒两种规格,实验温度为298
、308
,每次实验
的用量为25.0
、大理石用量为10.00
。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
大理石规格 |
浓度/ · | 实验目的 |
|
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究
浓度对该反应速率的影响; (Ⅱ)实验①和探究温度对该反应速率的影响; (Ⅲ)实验①和探究大理石规格(粗、细)对该反应速率的影响;) |
| ② |
||||
| ③ |
||||
| ④ |
(2)实验①中 质量随时间变化的关系见下图:

依据反应方程式 +
=
+
= +
+ ↑+
↑+ ,计算实验①在70-90
范围内
的平均反应速率(忽略溶液体积变化,写出计算过程)。
,计算实验①在70-90
范围内
的平均反应速率(忽略溶液体积变化,写出计算过程)。
(3)请在答题卡的框图中,画出实验②、③和④中
质量随时间变化关系的预期结果示意图。