化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g) CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。
(2)已知在一定温度下,
C(s)+CO2(g) 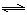 2CO(g) △H1
2CO(g) △H1
CO(g)+H2O(g) 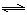 H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2
C(s)+H2O(g) 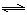 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是: 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如右表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如右表所示。
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
则该反应的正反应方向是 _反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g) 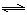 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是 :
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是 :

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只允许阴离子通过),阳极电极反应式为: .

在反应2F2+2H2O=4HF+O2中,作还原剂,元素被氧化;在反应Ca+2H2O=Ca(OH)2+H2↑中,作氧化剂,元素被还原。若在两个反应中,电子转移的物质的量相等时,产生氢气和氧气的质量比为。
已知化合物A、D、E、G焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多。A~H各物质的变化关系如下图所示。
(1)写出各步反应的化学方程式
反应①反应②
反应③反应④
反应⑤
(2)上述反应中属于氧化还原反应的有
氨的合成原理为:N2(g)+3H2(g) 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
回答下列问题:
(1)10 min内以NH3表示的平均反应速率;
(2)在10 ~20 min内:NH3浓度变化的原因可能是;
| A.加了催化剂 | B.缩小容器体积 | C.降低温度 | D.增加NH3物质的量 |
(3)第1次平衡的时间范围为:,第2次平衡的时间范围为:,
第1次平衡:平衡常数K1 = (带数据的表达式),第2次平衡时NH3的体积分数;
(4)在反应进行至25 min时:
①曲线发生变化的原因:
②达第二次平衡时,新平衡的平衡常数K2K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= 。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) 2NH3(g) +
2NH3(g) + 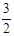 O2(g);△H =" a" kJ·mol—1
O2(g);△H =" a" kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a0;ΔS0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g) 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
下列方程式中(以下填写序号)
①CaCO3(s) ="=" CaO + CO2(g);ΔH= 177.7kJ/mol
②C(s) + H2O(g)="=" CO(g) + H2(g);ΔH= -131.3kJ/mol
③0.5H2SO4(l) + NaOH(l) ="=" 0.5Na2SO4(l) + H2O(l);ΔH= -57.3kJ/mol
④C(s) + O2(g) ="=" CO2(g);ΔH=-393.5kJ/mol
⑤CO(g) + 1/2 O2(s) ="=" CO2(g);ΔH=-283kJ/mol
⑥HNO3 (aq) + NaOH(aq) ="=" NaNO3(aq) + H2O(l);ΔH= -57.3kJ/mol
⑦2H2(g) + O2(g) ="=" 2H2O(l);ΔH= -517.6kJ/mol
(1)上述热化学方程式中,不正确的有______________________
(2)根据上述信息,写出C转化为CO的热化学方程式______________________。
(3)上述反应中,表示燃烧热的热化学方程式有__________________;
表示中和热的热化学方程式有_________
(6分)在密闭容器中进行如下反应:mA(g)+nB(g)  pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
(1)写出上述化学方程式中各物质的计量数:m=________,n=________,p=________
(2)压强一定时,C的百分含量(C%)与温度、时间(T表示温度,t表示时间)的关系如图所示。由此可知,该反应为 (填“吸热”或“放热”)反应。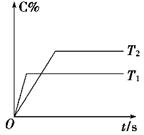
(3)该反应的平衡常数表示式为 ,升高温度,K值将 (填“增大”、“减小”或“不变”)。