甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g ) △H=—129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如右图。
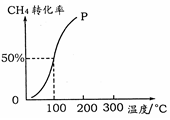
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.c ( H2 )减少 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 |
| D.重新平衡c ( H2 )/ c (CH3OH )减小 |
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:
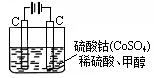
① 写出阳极电极反应式 。
② 写出除去甲醇的离子方程式 。
③若右图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式 ,净化含1mol甲醇的水燃料电池需消耗KOH mol。
钛被誉为“亲生物金属”,可以用来制作人造骨骼,而钛与聚氨酯树脂制作的人工心脏还利用了聚氨酯树脂良好的血液 性,而聚氨酯树脂又被称为 ,
是一种性能介于 和 的特殊材料。
去商场里我们看到商品架上“不粘锅”炊具和“不粘油”灶具,上面都涂了一层商业上 叫“特氟隆”的物质,这种物质的主要成分是 。由于它们的摩擦系数 ,表面非常光滑,所以十分容易清洗。而之所以用于炊具。是因为聚四氟乙烯的化学性质非常 。它的分子式是, 制备方程式是。
汽车作为曾经推动人类文明向前跃进的现代社会产物,在给人类生活带来便捷舒适的同时,对自然生态环境的恶化也带来了害处,它是城市空气的重要污染源之一。
(1)汽车尾气中的大气污染物有(写化学式)。
(2) 治理尾气的方法之一是在汽车的排气管上装一个“催化转化器”(用铂、钯合金制催化剂),它的作用是使CO和NO反应,生成两种气体,其中一种可以参与植物的光合作用,另一种是空气中含量最多的气体。请写出CO与NO反应的化学方程式。
(3)氢气做燃料的三个十分突出的优点是__________、__________、___________,就目前情况看,氢气作燃料的汽车要投入使用前,你认为还要研究解决的问题________________________________。
某学生为证明汽油中是否含有苯的同系物,他先取少量汽油放在试管中,再滴入数滴KMn04溶液,振荡后发现KMn04溶液退色,他得出了样品油中有苯的同系物的结论。分析此结论是否正确?若不正确请设计一个可行方案。
石油主要由烷烃、环烷烃和各种芳香烃组成,石油通过分馏、裂化可得直馏汽油和裂化汽油。现有直馏汽油和裂化汽油各一瓶。
(1)请从下列试剂中选择最合理的试剂予以区别。所选试剂是 。
A.KMn04(H+)溶液B.乙醇C.溴水
(2)加入所选试剂后,直馏汽油中观察到的现象是 ;裂化汽油
中观察得到现象是 。