化合物可根据其组成和性质进行分类。

(1)上图中的分类方法称为 ,其中①为 ;按这种分类方法,氧化物还可进一步分为 ;
烯烃中碳碳双键是重要的官能团,在不同条件下能发生多种变化。
已知①烯烃在催化剂作用下的复分解反应就是两种烯烃交换双键两端的基团,生成两种新烯烃的反应。
②烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的对应关系:
上述转化关系图中的物质:A和B都属于烃类,F是安息香酸,其蒸气密度是同温同压下H2密度的61倍,将0.61g F完全燃烧,产物通入足量的澄清石灰水中,产生3.5g沉淀。
根据以上信息回答下列问题:
(1)B的产量可以用来衡量一个国家石油化工发展的水平,B的名称是。
(2)E的同体可用于人工降雨,E的电子式是。
(3)H→I的反应类型是。
(4)L在一定条件下也可以生成一种高分子化合物W0 W可以作为手术的缝合线,其优点之一就是免拆线可被人体吸收。用W制成的塑料饭盒可降解,是环境友好材料。写出由L制W的化学方程式:。
(5)A的结构简式为:(任写一个)。
(6)K物质的核磁共振氢谱图上有____个吸收峰。
(7)若将NaOH溶于I后再与H混合加热,反应生成的有机产物最多有种,写出住意两种物质的结构简式(同一个碳原子上连有两个碳碳双键的结构不稳定,可不考虑)
、。
短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
(1)已知相关物质之间存在如下变化: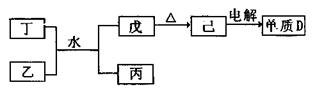
①丁与乙和水反应生成戊和丙的离子方程式为,由物质己电解得到单质D的化学方程式为;
②0.1mol/L的丙溶液中所含离子浓度由大到小排列顺序为;常温下,为使丙溶液中由丙电离的阴、阳离子浓度相等,应向溶液中加入一定量的乙的水溶液至。
(2)已知E及其化合物有以下变化:
写出单质E与化合物Z在一定条件下反应生成X和水的化学方程式____,由A、B、C、D、E5种元素中的两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为(任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的C的含氧酸盐的化学式是。
工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)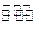 CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=(填计算结果)。
(2)合成培中发生反应N2(g)+3H2(g)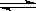 2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1300℃(填“>”、“<”或“=”)。
2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1300℃(填“>”、“<”或“=”)。
| T/℃ |
T1 |
300 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
(3) N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示。温度高于900℃时,NH3产率下降的原因。
(4)在上述流程图中,氧化炉中发生反应的化学方程式为。
(5)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H= -574kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)△H= -1160kJ·mol-1
则甲烷直接将N02还原为N2的热化学方程式为:。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为。
有机物A为羊肉的特征香成分。其合成路线如下: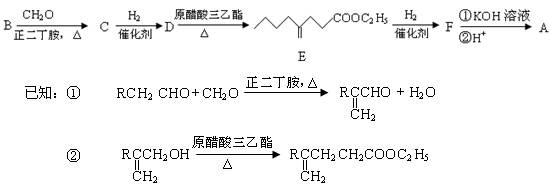
(1)B是烃的含氧衍生物,质谱表明B的相对分子质量为100,其中含氧元素的质量分数为16%。B能发生银镜反应,且分子结构中只有一个—CH3。B中含氧官能团的名称为;B的结构简式为。
(2)D能发生的化学反应类型有(填序号)。
①酯化反应②加成反应③消去反应④聚合反应
(3)下列关于E的说法中正确的是(填序号)
① E存在顺反异构②能使溴的四氯化碳溶液褪色
③能发生水解反应④分子式为C11H20O2
(4)写出B→C的化学方程式:。
(5)写出酸性条件下F→A的化学方程式:。
(6)若用系统命名法给A命名,A的名称为。
(7)与C含有相同官能团,分子结构中含有两个—CH3,一个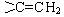 的同分异构体有种。
的同分异构体有种。
(8)与C含有相同官能团,分子结构中含有一个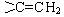 ,核磁共振氢谱有3个峰,且峰面积之比为9:2:1的同分异构体的结构简式为。
,核磁共振氢谱有3个峰,且峰面积之比为9:2:1的同分异构体的结构简式为。
工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g) 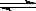 Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①中和含酸废水工业常用的试剂x是。
②写出H2S气体与足量NaOH溶液反应的化学方程式。
③铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式:。
④已知:2H2S(g)+O2(g) =" 2" S(s) +2 H2O(l)△H=" —632.8" kJ/mol
SO2 (g)=" S(s)" + O2(g)△H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为。