下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
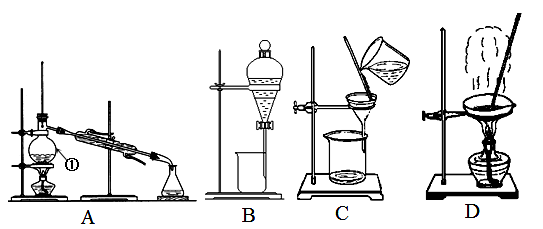
(1)从氯化钠溶液中得到氯化钠固体,选择装置 (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置 ;从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(2)装置A中①的名称是 ,
(3)实验室中制取的Fe(OH)3胶体中常常含有杂质Cl-离子。可用 的方法除去Fe(OH)3胶体中混有的杂质Cl- 离子。
某研究小组探究SO2和Fe(NO3)3溶液的反应。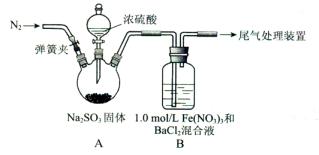
已知:1.0 mol/L的Fe(NO3)3溶液的pH=l
请回答:
(1)装置A中反应的化学方程式是____________。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是___________。
(3)装置B中产生了白色沉淀,其成分是____________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因:
观点1.____________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①按观点2,装置B中反应的离子方程式是___________,为证明该观点应进一步检验生成的新物质,其实验操作及现象是__________。
②按观点3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是(填序号)____________。
a.0.1 mol/L稀硝酸
b.1.5 mol/L Fe(NO3)2溶液
c.6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
海产品中常含有较多的碘元素,因此海边的居民很少患碘缺乏病。某化学兴趣小组的同学通过以下步骤提取海带中的碘:
(1)步骤 ③ 用到的玻璃仪器主要有漏斗、烧杯和。
(2)步骤 ⑤ 用有机溶剂苯将碘从水中提取出来的过程叫。静置分层后下层液体是。
(3)我国从1994年起推出全民食用加碘盐工程,至今,覆盖率已超过95%,补碘成效显著。我们可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾(KIO3),反应后可观察到溶液变蓝,该反应的离子方程式为_____。
某化学课外小组用下图装置制取溴苯,先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。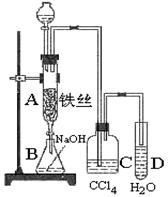
(1)写出A中反应的化学方程式
⑵实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是,写出有关反应的化学方程式。
⑶ C中盛放CCl4的作用是。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明该反应为取代反应。另一种验证的方法是向试管D中加入,现象是。
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的化学反应方程式为;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤②洗涤③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。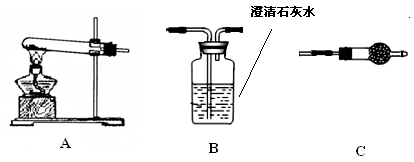

 (1)各装置连接顺序为。
(1)各装置连接顺序为。
(2)装置C中装有试剂的名称是。
(3)能证明生成物中有CuCO3的实验现象是。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过下列所示装置进行定量分析来测定其组成。
(1)装置C中碱石灰的作用是,实验开始时和实验结束时都要通入过量的空气其作用分别是
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为
。
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设假设1:红色粉末是Fe2O3假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?简述你的理由(不需写出反应的方程式 )
(3)若固体粉末完全溶解无固体存在 , 滴加KSCN 试剂时溶液不变红色 , 则证明原固体粉末是,写出发生反应的离子方程式、、。
探究延伸经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为。