一定温度下在体积为5L的密闭容器中发生可逆反应.
(1)若某可逆反应的化学平衡常数表达式为:K=c(CO)×c(H2)/c(H2O)
(1)写出该反应的化学方程式:_______________;
(2)能判断该反应一定达到化学平衡状态的依据是____________(填选项编号).
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 |
| D.容器中总的物质的量不随时间而变化 |
E.消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1mol H2O(g),t1秒时,H2的物质的量为0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol.
(1)t1~t2这段时间内的化学反应速率v(H2)=__________.
(2)若继续加入2mol Fe(s),则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1mol H2O(g) 再次达到平衡后,H2的物质的量为____________mol.
(3)该反应的逆反应速率随时间变化的关系如右图.t1时改变了某种条件,改变的条件可能是__________(只要写其中一种答案即可)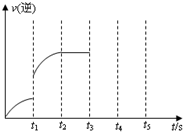
标准状况下,① 4g氢气 ② 33.6L甲烷(CH4) ③ 6.02×1023个水分子中,含分子数最多的是(填写序号,下同)_____,含原子数最多的是_____,质量最大的是______,体积最小的是______。
某双原子分子构成的气体,其摩尔质量为Mg·mol-1,该气体质量为ng,阿伏加德罗常数为NA,则:(1)该气体的物质的量为________mol。(2)该气体的标准状况下的体积约为________L。
(3)该气体所含原子总数为________个。(4)该气体的一个分子的质量为________g。
将标准状况下22.4 L的HCl溶于水配成200 mL的溶液,所得溶液的物质的量浓度为_____mol/L;配制300 mL 0.5 mol·L-1氯化钠溶液,需要1.5 mol·L-1的氯化钠溶液的体积是________mL。
(每空1分,共15分)利用“化学计量在实验中的应用”的相关知识进行填空
(1)0.2 mol NH3气体中含的NH3分子数是,其中含氢原子数是,含有电子的物质的量是.
(2)1摩尔Ba(OH)2固体中含有的Ba2+的个数是,全部溶于水,电离产生的OH-的物质的量是mol,通入二氧化碳气体,恰好完全反应,消耗的二氧化碳的物质的量是摩尔。
(3)H2SO4的摩尔质量是,49gH2SO4中含有mol氧原子,含有氢的质量是。能与摩尔NaOH恰好完全反应,生成水的质量是克。
(4)含有6.02×1023个氧原子的H3PO4的物质的量是_________
(5)与标准状况下VLCO2所含氧原子数目相同的水的质量是_______(用分式表示)
(6)将4 g NaOH溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为__________________
(7)在一定的温度和压强下,1体积X2 (g)跟3体积Y2 (g)化合生成2体积化合物,则该化合物的化学式是_______________
(每空2分,共16分)实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液480 mL: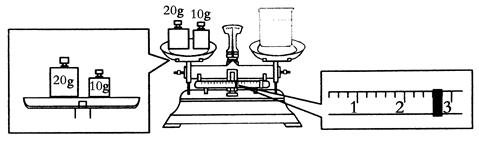
(1)配制时,必须使用的玻璃仪器有________、________、________、________。
(2)要完成本实验该同学应称出NaOH________g。
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为________g。
(4)使用容量瓶前必须进行的一步操作是________。
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________。
①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线