25℃时,电离平衡常数:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数 |
1.8×10﹣5 |
K1=4.3×10﹣7 K2=5.6×10﹣11 |
3.0×10﹣8 |
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是: ;(填编号)
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是: ;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c (OH﹣)/ c(H+)
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.

则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是 ,
稀释后,HX溶液中水电离出来的c(H+) 醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)= .(填准确数值).
氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图1是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式____
(2)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如右图所示
2NH3(g) △H=-92.4kJ·mol-1用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如右图所示
此时甲、乙、丙三个容器中一定达到化学平衡状态的是 ,都达到平衡状态时,NH3的质量分数最高的是____ 。
下图2是实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)="0.10" mol/L,c(H2) =" 0.26" mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示。
I.该反应实验②平衡时H2的转化率为 。
II.据图2所示,②装置中有一个条件与①不同。请指出②相对①改变的条件 。
III.计算实验③的平衡常数为___________________。
(3)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入碱性电解质溶液中,一个电极通入空气,另一电极通入NH3.其电池反应生成一种单质和一种化合物,写出负极的电极反应式 。
(4)铜与一定浓度硝酸反应时方程式可表示为:Cu+HNO3一Cu(NO3)2+NO +NO2 +H2O(方程式未配平)。3.2 g Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下NO体积为_______ L。
无水氯化铜是铜(II)的氯化物,化学式为CuCl2,棕黄色固体,吸收水分后变为蓝绿色的二水合物,实验室用如下装置制备少量无水氯化铜。完成下列填空:
(1)写出烧瓶中(B处)发生反应的化学方程式:____。
(2)c中盛有的试剂为 ,进行实验时应先点燃__(选填“B”或“D”)处酒精灯。
(3)F中盛有碱石灰,其目的是____(选填序号)。
a.吸收HCl b.吸收Cl2 c.吸收CO2 d.吸收H2SO4
(4)将D中固体改为市售氯化铜(CuCl2.2H2O,Mr=171),也能进行无水氯化铜的制备,此时向D中通入HC1气体,目的是 。若实验条件控制不当,最终得到的物质是碱式氯化铜[化学式为Cu4(OH)nCl(8-n)],且质量是原市售氯化铜的62.7%,则可推算n的值为 (整数值)。
(5)有同学提出将上述装置F(干燥管)改为碱液来处理尾气,请在方框内画出尾气处理装置图。
A、B、C、D、E五种常见元素的核电荷数依次增大。A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素, D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子。请回答下列问题:
(1)E的基态原子价层电子排布式为 。
(2)AB2分子中,A的杂化类型为 ;在元素周期表中A、B及与两者紧邻的元素的第一电离能由大到小的顺序为(用元素符号表示) 。
(3)B的氢化物与D的氢化物的沸点较高的是 (用化学式表示),原因是 。
(4)AB2形成的晶体的熔点 (填“高于”“低于”或“无法判断”)CD形成的晶体的熔点,原因是 .
(5)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为 (用元素符号表示)。ED4是制取航天航空工业材料的重要原料。取上述橙红色晶体,放在电炉中,通入D2和A的单质后高温加热,可制得ED4,同时产生一种造成温室效应的气体,写出反应的化学方程式 。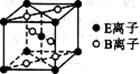
(6)由C、D两元素形成的化合物组成的晶体中,晶胞结构图以及晶胞的剖面图如下图所示,若晶胞边长是acm,则该晶体的密度为 g·cm-3。(已知阿伏伽德罗常数为NA)。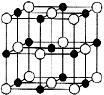
铁及其化合物与生活密切相关,古代炼丹家以绿矾(FeSO4·7H2O为原料,放在炼丹炉中锻烧可制得绿矾油。绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈。右图是2. 78 g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g。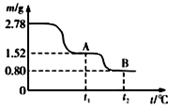

(1)绿矾油主要成份的化学式为 。t1~t2.发生反应的化学方程式为 。
(2)若将28.8 g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到14.4 g黑色细粉,则可推知该黑色细粉为 。
(3)以下是FeSO4·7H2O的实验室制备流理图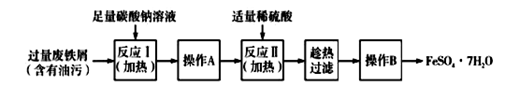
根据题意完成下列填空:
①反应II需要100 mL1. 5 mol·L-1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1. 84 g·cm -3的浓H2SO4配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 。
②操作A的名称为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取6.0 g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.2000 mol·L -1KMnO4溶液滴定,消耗KMnO4溶液的体积为20. 00 mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。
“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:CO2(g) + 3H2(g) ⇌CH3OH(g) + H2O(g)△H =﹣49.0 kJ/mol。相关数据如下:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1 mol CO2(g)和3 mol H2(g) |
1 mol CH3OH(g)和1 mol H2O(g) |
| 平衡时c(CH3OH) |
c1 |
c2 |
| 平衡时能量变化 |
放出29.4 kJ |
吸收a kJ |
请回答:
①c1 c2(填“>”、“<”或“=”);a = 。
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是 mol/(L·s)。
(2)压强为p1时,向体积为1 L的密闭容器中充入b mol CO和2b mol H2,发生反应CO(g)+2H2(g) ⇌CH3OH(g)。平衡时CO的转化率与温度、压强的关系如图所示。请回答:
①该反应属于 (填“吸”或“放”)热反应;
p1 p2(填“>”、“<”或“=”)。
②100℃时,该反应的平衡常数K= (用含b的代数式表示)。
(3)治理汽车尾气的反应是2NO(g)+2CO(g)⇌2CO2(g)+N2(g)△H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是 (选填字母)。



a b c d