草酸亚铁晶体的化学式为FeC2O4·2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4·2H2O FeO +CO2↑+CO↑+H2O
FeO +CO2↑+CO↑+H2O
(1)请你用下图中提供的仪器(可以重复选用,但每种仪器至少选用一次),选择必要的试剂[供选择的试剂:NaOH溶液、澄清石灰水、饱和碳酸钠溶液、CuO、无水硫酸铜、酸性高锰酸钾溶液],设计一个实验,检验FeC2O4·2H2O加热时分解产生的气态产物(包括水蒸气)(部分加热装置和夹持仪器在图中略去)。在答题卡上填写下表(可以不用填满,也可以补充)。

| 仪器符号 |
仪器中所加物质 |
作用 |
| A |
草酸亚铁晶体 |
加热草酸亚铁晶体得到气体产物 |
| |
|
|
| |
|
|
| D |
NaOH溶液 |
|
| |
|
|
| |
|
|
| |
|
|
| |
|
|
(2)按照题目提供的装置和要求设计的实验明显存在的一个不足是 。
(3)反应结束后,在A装置试管中有黑色固体粉末(混合物)产生,倒出时存在燃烧现象,产生上述现象的可能原因是 。
工业上用丙烯制取甘油的过程可简单表示如下:
其中B、C互为同分异构体,试写出①—④步反应的化学方程式(有机物用结构简式表示)。
在中学化学实验室中,可通过下图的方法制得一种常见的有毒气体 。
。

 是黑色粉末,
是黑色粉末, 是白色固体(焰色反应透过蓝色钴玻璃呈紫色,可用于制备火柴),且都是常见的氧化剂。
是白色固体(焰色反应透过蓝色钴玻璃呈紫色,可用于制备火柴),且都是常见的氧化剂。
(1)写出 与W的浓溶液共热生成
与W的浓溶液共热生成 的离子方程式 。
的离子方程式 。
(2)  与
与 混合后共热可产生一种无毒气体,反应的化学方程式为。
混合后共热可产生一种无毒气体,反应的化学方程式为。
下图是实验室常见的气体发生装置,此反应应选用的发生装置是(填字母编号)。实验过程中,检验气密性之后(气密性良好),向该装置中加入粉末状固体的操作是:。
(3)  与乙烯加成可得一种有机物,为验证该有机物中含有与
与乙烯加成可得一种有机物,为验证该有机物中含有与 相同的元素,请选择合适的试剂(用字母编号回答)。
相同的元素,请选择合适的试剂(用字母编号回答)。
a.稀盐酸 b.稀硝酸 c.稀硫酸 d.氢氧化钠溶液
e.硝酸银溶液 f.淀粉溶液 g.碘化钾溶液 h.品红溶液
(4)在实验室中制取气体 时,通常可用排某种溶液的方法收集
时,通常可用排某种溶液的方法收集 ,则该溶液是;也可用排空气集气法收集
,则该溶液是;也可用排空气集气法收集 ,若用右图装置(不能改变瓶口朝向),则气体应该从(填“m”或“n”)口进。
,若用右图装置(不能改变瓶口朝向),则气体应该从(填“m”或“n”)口进。
(5)有人设想利用原电池原理以 和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入
和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入 的电极为原电池的极,其电极反应式为。
的电极为原电池的极,其电极反应式为。
某同学用含硫酸亚铁等杂质的工业硫酸铜制取纯净的氧化铜以探究其性质。
(1)制备氧化铜
①将工业硫酸铜加适量水溶解、搅拌、过滤除去不溶性杂质。简述检验滤液中含有Fe2+的操作方法:。
②向滤液中滴加H2O2溶液,稍加热,当Fe2+转化完全后,为将Fe3+全部转化为Fe(OH)3沉淀,而不会将Cu2+转化为沉淀,需慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5。加热煮沸后过滤,用稀硫酸酸化滤液至pH=1。再从溶液中分离出硫酸铜晶体。Fe2+转化为Fe3+的离子方程式是。
③在测定所得硫酸铜晶体(CuSO4·xH2O)x值的实验中,所用的玻璃仪器名称为:酒精灯、
玻璃棒、,实验过程中称量操作至少进行次。
④用得到的硫酸铜晶体制氧化铜。
(2)探究氧化铜的性质
在加热条件下,向下图所示装置中持续通入某纯净物X的蒸气,a处黑色物质变为红色,b处白色粉末变为蓝色,c处有无色液体产生。(设各步反应均进行完全)
则X可能是(填一个化学式即可),X与CuO反应的化学方程式是
。
下图为苯和溴的取代反应的改进实验装置图,其中A为具有支管的试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。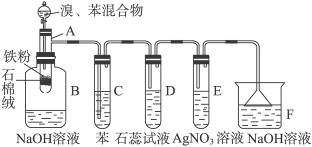
完成下列问题:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):______________________。
(2)试管C中苯的作用是______________________。反应开始后,观察D和E两试管,看到的现象为______________________。
(3)反应2 min—3 min后,在B中的NaOH溶液里可观察到的现象是____________________。
(4)在上述整套装置中,具有防倒吸作用的仪器有__________ (填字母)。
(5)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是____________________。
实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50—60 ℃下发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例浓硫酸与浓硝酸混合酸时,操作注意事项是________________________。
(2)步骤③中,为了使反应在50—60 ℃下进行,常用的方法是________________________。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是____________。
(4)步骤④中粗产品用5% NaOH溶液洗涤的目的是_________________________________。
(5)纯硝基苯是无色,密度比水______ (填“大”或“小”),具有______气味的油状液体。