某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=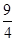 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
下列判断不正确的是
A.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
B.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
C.平衡时,乙中CO2的转化率大于60%
D.平衡时,甲中和丙中H2的转化率均是60%
下列实验结论正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
取待测液先进行焰色反应,再加足量稀盐酸,将产生气体通入品红溶液 |
火焰呈黄色,品红溶液褪色 |
原溶液一定是亚硫酸钠溶液 |
| B |
向浓醋酸溶液中加入少量碳酸钠溶液,将产生气体通入苯酚钠溶液 |
苯酚钠溶液中出现白色浑浊 |
说明酸性:醋酸>碳酸>苯酚 |
| C |
常温下向足量浓度较大的硫酸和稀硫酸中,分别加入相同质量、相同体积的铁片 |
相同时间两者产生H2速率不同[来 |
反应物的浓度越大,反应速率越快 |
| D |
相同的铝片分别与同温同体积,且c(H+)="1" mol·L¯1的盐酸、硫酸反应 |
铝与盐酸反应产生气泡较快 |
可能是Cl-对该反应起到促进作用 |
某学生鉴定甲盐的流程如图所示,下列说法正确的是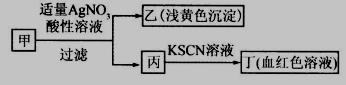
| A.如果甲中含有S2-,则乙是硫磺沉淀 |
| B.如果乙是AgCl沉淀,那么甲是FeCl3 |
| C.丙中肯定含有Fe3+,所以甲是FeBr2 |
| D.甲中含有铁元素,可能显示+2或者+3价 |
A、B、C、X均为中学化学常见的物质,一定条件下,它们有如下转化关系(部分产物已略去),下列说法错误的是
A.若X为Cl2,则C可能为FeCl3
B.若X为KOH溶液,则A可能为AlCl3溶液
C.若X为O2,则A可能为H2S或NH3
D.若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。
根据上述实验,以下推测不正确的是
| A.原溶液一定不存在H+、Cu2+、CO32- |
| B.不能确定原溶液是否含有K+、NO3- |
| C.实验所加的NaOH的浓度为2mol·L-1 |
| D.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2 |
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是
| A.用装置甲制取氯气 |
| B.用装置乙除去氯气中的少量氯化氢 |
| C.用装置丙分离二氧化锰和氯化锰溶液 |
| D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O |