实验室常用的几种气体发生装置如图A、B、C所示:
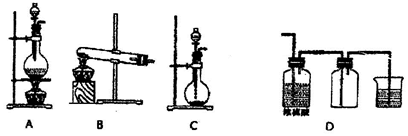
(1)实验室可以用B或C装置制取氨气,如果用C装置,检查C装置气密性是否良好的操作方法是__________________________。
若用B装置制取氨气,用化学方程式表示制取氨气的反应原理_____________________。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的气体发生装置是_______,用离子方程式表示制取氯气的反应原理________________________。
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的______
①CO2 ② NO ③ Cl2 ④ H2 其中在D装置连接小烧杯目的是________________
(4)下图是某同学设计收集氨气的几种装置,其中可行的是_________________。
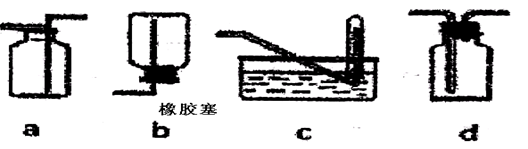
(5)某兴趣小组同学模拟工业上用离子交换膜法制烧碱的方法,设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为_______________。
②得到的硫酸从 (填A,或D)排放出。
③此时通过阴离子交换膜的离子数 (填大于,小于或等于)通过阳离子交换膜的离子数。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池负极的电极反应式为
实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: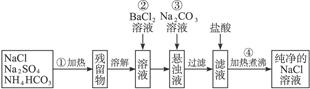
图1-7
如果此方案正确,那么:
(1)操作①可选择____________或____________仪器。
(2)操作②是否可改为加硝酸钡溶液?为什么?
(3)进行操作②后,如何判断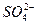 已除尽,方法是____________。
已除尽,方法是____________。
(4)操作③的目的是_________________________________________,为什么不先过滤后加碳酸钠溶液?理由是_________________________________________________。
(5)操作④的目的是
_____________________________________________________________。
实验室进行NaCl溶液蒸发时,一般有以下操作过程,其正确的操作顺序是( )
①放置酒精灯②固定铁圈的位置③放上蒸发皿④加热搅拌⑤停止加热、余热蒸干
| A.①③②④⑤ |
| B.①②③④⑤ |
| C.②③①④⑤ |
| D.②①③④⑤ |
下列实验操作错误的是( )
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应将溶液蒸干 |
| D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
某兴趣小组的学生根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧。为了确定其生成产物并进行实验论证,请你参与以下研究过程。
(1)甲同学首先设计了实验室制取二氧化碳的三种发生装置,若选用碳酸氢钠分解制二氧化碳应选用装置是_______(填装置序号“A”“B”或“C”,下同);若用石灰石与稀盐酸为原料,并能控制反应随时发生随时停止,最好应选用的装置是_______;若用碳酸钠固体与稀硫酸反应应选用的装置是_______。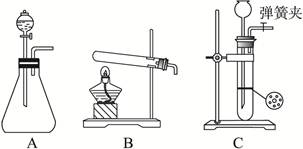
(2)乙同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题: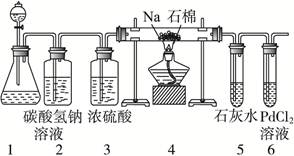
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:_____________________。
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:_____________________。
(3)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有Na2O和C。
某化学课外小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题。可供选择的试剂有:
| A.大理石 | B.盐酸 | C.氢氧化钠溶液 | D.澄清石灰水。三名同学设计的制备实验方案的反应流程分别如下: |
甲:NaOH溶液 Na2CO3溶液
Na2CO3溶液
乙:NaOH溶液 NaHCO3溶液
NaHCO3溶液 Na2CO3固体
Na2CO3固体 Na2CO3溶液
Na2CO3溶液
丙:NaOH溶液 NaHCO3溶液
NaHCO3溶液 Na2CO3溶液
Na2CO3溶液
请完成下列问题:
(1)请指出甲、乙两方案的主要缺点:
甲方案_______________________________________。
乙方案_______________________________________。
(2)若采用丙方案制取纯Na2CO3溶液,其实验的关键有________________。
(3)假设反应③所得的NaHCO3溶液中含有Na2CO3。现要利用A~D四种试剂证明Na2CO3的存在,你所选择的试剂有_________________(填试剂代号在题干中)。
(4)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3。乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学能否达到实验目的?(填“能”或“不能”)。若能,请说明其计算需要的数据;若不能,请简要说明理由。
_____________________________________。