氮元素能形成多种多样的化合物。
(1)己知N2O4 (g) 2NO2 (g) ΔH=+57.20 kJ/mol ,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2 (g) ΔH=+57.20 kJ/mol ,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
| c(X)/(mol/L) |
0.2 |
c |
0.6 |
0.6 |
1.0 |
c1 |
c1 |
| c(Y)/(mol/L) |
0.6 |
c |
0.4 |
0.4 |
0.4 |
c2 |
c2 |
①c(X)代表 (填化学式)的浓度,该反应的平衡常数K= 。
②20 min时改变的条件是 ;重新达到平衡时,N2O4的转化率将 (填选项前字母)。
a.增大 b.减小 c.不变 d.无法判断
③t℃时,下列情况不能说明该反应处于平衡状态的是 ;
A.混合气体的密度保持不变 B.混合气体的颜色不再变化
C.混合气体的气体压强保持不变 D.N2O4与NO2的物质的量比为10:3
④若反应在t℃进行,某时刻测得n(NO2)="0.6" mol、n(N2O4)=1.2mol,则此时v(正) v(逆)(填 “>” 、“<”或“=”)。
(2)已知2N2H4(l)+N2O4(l)="3N2(g)+4H2O(l)" ΔH=" -1225" kJ/mol
| 化学键 |
N-H |
N-N |
N≡N |
O-H |
| 键能(kJ/mol) |
390 |
190 |
946 |
460 |
则使1 mol N2O4 (l)完全分解成相应的原子时需要吸收的能量是 。
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、H+、Mg2+、Ba2+、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加入足量NaHCO3溶液后,收集到气体0.03mol。
②第二份加足量Ba(NO3)2溶液充分反应后过滤干燥,得干燥沉淀4.66g。
根据上述实验回答:
(1)原溶液中一定不存在的离子是_____________________。
(2)原溶液中可能存在的离子是_______________________。
(3)请计算出原溶液中一定存在的阴离子是 ,其物质的量浓度为_____________。
下列各组物质的分离或提纯,应选用下述方法的哪一种(填序号)
| A.分液 | B.过滤 | C.萃取 | D.蒸馏 |
E.蒸发结晶 F.加热分解
(1)除去CaCl2溶液中的CaCO3 ;
(2)除去KCl固体中的KClO3 ;
(3)用食用酒精浸泡中草药提取其中的有效成分 ;
(4)分离苯和四氯化碳 。
(1)常压、100℃时,等质量的SO2气体和SO3气体的密度之比为 ,原子数之比为 ,体积之比
(2)有CO与CO2的混合气体共10.8 g,标准状况下其体积为6.72L。则混合气体中二氧化碳的物质的量为 ,若混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体质量为 。
(3)将0.1 mol·L-1的K2SO4溶液、0.2 mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、SO42-的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,求K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比 。(忽略体积的变化)
在0.4 L由NaCl 、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。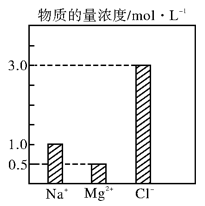
(1)该混合液中,NaCl的物质的量为____________mol,含溶质MgCl2的质量为______________g。
(2)该混合液中CaCl2的物质的量为____________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为______________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀____________mol。
(1)18.4 g氮的氧化物N2Ox中含氮原子0.4 mol,则N2Ox的摩尔质量为 ;x= ;
(2)设一个12C原子的质量为a g,一个R原子的质量为b g,阿伏加德罗常数的值为NA,则R的相对原子质量可以表示为__________________
(3)标准状况下,224L的NH3溶于680 ml水中,所得溶液的溶质质量分数为 ,若该溶液的密度为 a g/cm3,则其物质的量浓度为 mol·L-1。将上述氨水全部转化为NH4Cl,所需2 mol/L的盐酸的体积为 L(已知:NH3+HCl=NH4Cl)