工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有 和 。
某温度下,纯水中c(H+) = 2×10-7 mol•L-1,则此温度____________25°C(填“>”、“<”或“=”)。若温度不变,滴入稀盐酸,使c(H+) = 8×10-4 mol•L-1,则此时溶液中由水电离产生的c(H+) =____________。
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 |
H+ |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
未测定 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH约为 。
(2)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料。
已知:2H2(g)+O2(g)=2H2O(g) K1 2C(s)+O2(g)=2CO(g) K2
2C(s)+2H2O(g)=2CO(g)+2H2(g) K则K=_____________(用含K1、K2的式子表示)。
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 。
A.Ca(OH) 2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化,已知汽缸中生成NO的反应为:
N2 (g)+O2(g) 2NO(g)△H
2NO(g)△H 0
0
目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
在抗击非典型性肺炎期间,过乙酸(过氧乙酸)曾被广泛用做消毒剂。已知硫酸和过硫酸的结构简式如下: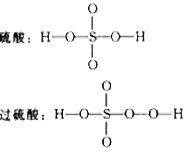
请从以下八个式子中选择答案回答下列问题(答案用编号表示):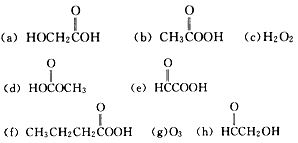
(1)过乙酸(过氧乙酸)的结构简式是______________。
(2)过乙酸的同分异构体是______________。
(3)过乙酸的同系物是_____________。
有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写为 .有机物X的键线式为
.有机物X的键线式为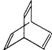
(1)有机物Y是X的同分异构体,且属于芳香烃,请写出Y的结构简式: 。
(2)Y与乙烯在一定条件下发生等物质的量聚合反应,请写出其反应的化学方程式:____________。
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有____种。
I. H2A在水中存在以下平衡:H2A  H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为 。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是______________。
| A.c(Na+ )>c(K+ ) | B.c(H +)•c(OH )=1×10-14 |
| C.c(Na+ )=c(K+ ) | D.c(Na+ )+c(K+ )=c(HA- )+c(A2-) |
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含4.00×10-3 mol/L Cr2O72-。为使废水能达标排放,作如下处理:
(3)该废水中加入FeSO4•7H2O和稀硫酸,发生反应的离子方程式为: 。
(4)欲使25 L该废水中Cr2O72- 转化为Cr3+,理论上需要加入_________g FeSO4•7H2O。
(5)若处理后的废水中残留的 c(Fe3+)=1×10-13mol/L,则残留的 Cr3+的浓度为_________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol,/L,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
III.已知:I2+2S2O32-==2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
(6)步骤c中判断恰好反应完全的现象为
(7)根据以上实验和包装袋说明,所测精制盐的碘含量是 mg/kg。(以含w的代数式表示)