某化学实验小组需用480 mL 0.5 mol/L的硫酸铜溶液,请回答下列问题:
(1)如果用胆矾(CuSO4·5H2O)来配制,需用胆矾的质量为________g。
(2)下面是配制硫酸铜溶液过程中的5个操作步骤:①向盛有胆矾的烧杯中加入20 mL蒸馏水使其溶解;②继续往容量瓶中加蒸馏水,至液面距刻度线1~2 cm处;③将烧杯中的溶液沿玻璃棒注入500 mL容量瓶中;④向烧杯中加入少量的蒸馏水,洗涤烧杯内壁和玻璃棒2~3次后移入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;⑤改用胶头滴管加蒸馏水至刻度线,盖好瓶塞,反复上下颠倒,摇匀。正确的操作顺序为__________________(填序号)。
(3)上述操作中,①、③都用到玻璃棒,其作用分别为________、________。
(4)下列操作会导致所配硫酸铜溶液物质的量浓度偏低的是________(填序号,下同);对所配溶液物质的量浓度无影响的是________。
①在烧杯中搅拌溶液时,有少量液体溅出
②定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线
③容量瓶使用前未进行干燥
④所使用的容量瓶刚用某种浓度的硫酸铜溶液润洗过
⑤定容后,塞好瓶塞摇匀,装入用蒸馏水洗净的试剂瓶中
⑥没有洗涤溶解时所用的烧杯和玻璃棒
高氯酸铵样品中 NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装置已略去),实验步骤如下: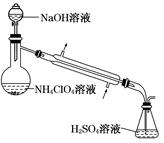
步骤 1:按如图所示组装仪器,检查装置气密性。
步骤 2:准确称取样品a g (约 0.5 g)于蒸馏烧瓶中,加入约 150 mL 水溶解。
步骤 3:准确量取 40.00 mL 约 0.1 mol·L-1 H2SO4溶液于锥形瓶中。
步骤 4:经滴液漏斗向蒸馏烧瓶中加入 20 mL 3 mol·L-1NaOH 溶液。
步骤 5:加热蒸馏至蒸馏烧瓶中剩余约 100 mL 溶液。
步骤 6:用新煮沸过的水冲洗冷凝装置 2~3 次,洗涤液并入锥形瓶中。
步骤 7:向锥形瓶中加入酸碱指示剂,用 c mol·L-1NaOH 标准溶液滴定至终点,消耗 NaOH 标准溶液 V1 mL。
步骤 8:将实验步骤 1~7 重复 2 次。
①步骤 3中,准确量取 40.00 mL H2SO4溶液的玻璃仪器是。
②步骤 1~7 中,确保生成的氨被稀硫酸完全吸收的实验步骤是(填步骤序号)。
③为获得样品中 NH4ClO4的含量,还需补充的实验是。
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、和。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为(保留小数点后四位)。
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol·L-1) |
0.001 0 |
0.010 0 |
0.020 0 |
0.100 0 |
0.200 0 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将(填“增大”“减小”或“不变”)。
实验三:探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案:
。
无水氯化亚铁用于制造铁系催化剂、印染的媒染剂和染料还原剂,还可用于冶金、医药、照相等行业。一实验小组模仿工业方法制取氯化亚铁,设计装置如下
通过查阅相关资料可知:
①在持续高温500℃时,铁与纯净、干燥Cl2反应可生成FeCl2,在温度较低时可生成FeCl3;
②FeCl3熔沸点低,易升华。
根据以上信息回答相关的问题
(1)abc仪器组合成制取氯气的装置,反应无需加热,请写出a容器内所发生的化学反应方程式 。
(2)d、e盛装的药品分别是 和 ,f、g的作用是 。
(3)反应器为硬质玻璃管,纯净铁粉与氯气在500℃左右反应。
①化学反应方程式为
②实验操作顺序是:组装仪器、 、装入药品、 、 、停止加热、关闭c的活塞。
(4)实验小组记录的实验现象如下:
| 观察到的部分现象 |
|
| 第一次实验 |
反应器中有白雾、红色固体、g瓶有白雾和黄绿色气体 |
| 第二次实验 |
反应器中有绿色晶体,g瓶有红棕色的烟和黄绿色气体 |
| 第三次实验 |
反应器中有绿色晶体,g瓶有黄绿色气体 |
①第一次实验,发现e瓶没有盛装任何药品,所以得到红色固体,其原因是 。
②第二次实验,g瓶有红棕色的烟,其原因是 。
(5)第三次实验得到的固体,最可能含有微量杂质是 ,如果需要配制约2~3mol/L的染料还原剂溶液,则无需除去,理由是 。
阿司匹林(乙酰水杨酸,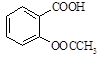 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
主要试剂和产品的物理常数
请根据以上信息回答下列问题:
(1)①合成阿斯匹林时,最合适的加热方式是。
②抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是。
(2)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤,则加饱和NaHCO3溶液的目的是。
另一种改进的提纯方法,称为重结晶提纯法。方法如下: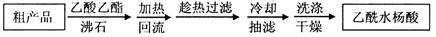
(3)改进的提纯方法中加热回流的装置如图所示,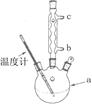
①使用温度计的目的是。冷凝水的流进方向是。(填“b”或“c”)。
②重结晶提纯法所得产品的有机杂质要比原方案少的原因。
(4)检验产品中是否含有水杨酸的化学方法是。
(5)该学习小组在实验中原料用量:2.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品m=2.2 g,则所得乙酰水杨酸的产率为。
铜是人类最早生产和使用的金属之一,在化学反应中铜元素可表现为0、+1、+2价。
Ⅰ.(1)在西汉古籍中曾有记载:“曾青得铁则化为铜”,即:曾青(CuSO4)跟铁反应生成铜,试写出该反应的离子方程式 。
(2)在原电池和电解池中,铜常用作电极,下列有关说法正确的是
| A.锌铜原电池中铜是正极 | B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上镀铜时铜与电源正极相连 | D.铜作阳极时不一定溶解 |
Ⅱ.学习小组对无水硫酸铜分解的产物进行实验探究。
【提出问题】碳酸钙受热分解生成CaO和CO2,那么无水硫酸铜受热分解也只生成CuO和SO3吗?
【设计实验】按如图装置进行试验。
|
