某研究小组以CaCl2和H2为原料,试图制备 +1价Ca的化合物,结果发现产物中只有两种化合物(甲和乙)。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性。请回答下列问题:
(1)生成甲的化学反应方程式为
(2)甲与水反应可得H2,其化学方程式是 。
(3)在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是 ;乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
(4)请写出一个你认为可能得到CaCl的化学方程式(以CaCl2为原料) 。
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是 。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。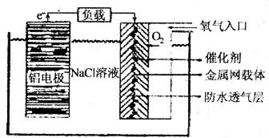
①该电池的总反应化学方程式为 ;
②电池中NaCl的作用是 。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为 。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为
(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为 。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式 。
【化学——选修5:有机化学基础】避蚊酯(DMP)是一种塑化剂,相对分子质量为194,摄入后对人体有一定的危害,其结构可表示为 (其中R为烃基)。实验室由以下方法可得到DMP:
(其中R为烃基)。实验室由以下方法可得到DMP:
请回答:
(1)DMP的结构简式为 ,物质C中官能团的名称为 。
(2)下列有关DMP的说法可能正确的是 。(填字母标号)
A.DMP分子的核磁共振氢谱图中有六个峰
B.DMP可以发生取代、加成、氧化等反应
C.DMP在水中的溶解度不大
(3)B与乙二酸( )在一定条件下可以按物质的量1:1发生反应生成高分子化合物,反应的化学方程式为 。
)在一定条件下可以按物质的量1:1发生反应生成高分子化合物,反应的化学方程式为 。
(4)工业上以邻二甲苯( )为原料先生产苯酐
)为原料先生产苯酐 ),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为 。
),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为 。
(5)芳香化合物E与C互为同分异构体,若1mo1E与足量银氨溶液反应最多只能析出2mo1 Ag,则E可能的结构简式为 。B也有多种同分异构体,符合以下条件的B的同分异构体有种 。
①1mo1有机物可以与2mo1NaOH反应
②苯环上的一氯代物只有一种
【改编】[化学—选修3:物质结构与性质](15分)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。F是第四周期元素,F原子的基态电子排布中有4个未成对电子;
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,C元素的气态氢化物的VSEPR模型为 。B2A4是重要的基本石油化工原料,1 mol B2A4分子中含_______molσ键。
(4)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 。
(5)已知D、E能形成晶胞如图所示的两种化合物,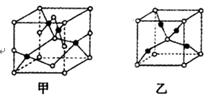
化合物的化学式,甲为________,乙为_________;高温时,甲易转化为乙的原因为_______________。
【化学-选修2:化学与技术】水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)水的净化和软化的区别是________。
(2)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是_________。
②下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是_______填字母)。
a.福尔马杯 b.漂白粉 c.氯气 d.臭氧
(3)Na2FeO4是一种新型水处理剂,工业上可用FeSO4制备Na2FeO4其工艺流程如下:
①工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加人绿矾。请解释这一做法的原因:________________________。(用必要的离子方程式和文字描述)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式:____________。
(4)石灰纯碱法是常用的硬水软化方法,已知25℃时 ,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为
,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为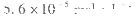 ,则生成沉淀所需Ca(OH)2溶液的最小浓度为____________。
,则生成沉淀所需Ca(OH)2溶液的最小浓度为____________。
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有 。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式: 。
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为: 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明主要操作步骤 、 。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为 。