维生素和微量元素是生命基础的重要物质。如中学生每天需要补充维生素C约60㎎,微量元素碘约150μg。
(1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变___色。某同学欲探究维生素C的还原性,可选择的试剂是_____(填序号)。
①碘水、淀粉 ②KI溶液 ③酸性KMnO4溶液
(2)食用加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为____(填序号)。
①I2 ②KI ③KIO3
已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验碘盐中的碘酸钾,可观察到的现象是__________。
铬是水体的主要的污染物之一,可以导致水生生物死亡。化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质。例如处理铬的实验循环示意图如下: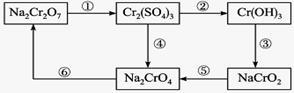
(1)在上图所示的编号步骤中,其中反应①所用的试剂是硫酸酸化的H2O2,请写出该反应的离子方程式 。
(2)现有含Cr3+和Fe3+的溶液,使用NaOH溶液和盐酸,可将这两种离子相互分离,根据上图信息分析,在涉及的过滤操作中,上述两种离子的存在形态分别是__________、 。(写化学式)
(3)铬的化合价除了示意图中涉及的+3和+6外,还有0、+2、+4和+5等。
现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的Na2Cr2O7溶液完全反应。已知Na2SO4被Na2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 。
(4)步骤⑤应该加入________剂(填“还原”或“氧化”)。
计算:
(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比是 ,质量之比是 ,密度之比是
(2)下列所给出的几组物质中:含有分子数最多的是 ;含有原子数最多的是 ;标准状况下体积最大的是 。(填序号)
①1gH2; ②2.408×1023个CH4;③10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏加德罗常数,如果ag某气体含有的分子数是b,则cg该气体在标准状况下的体积是 (用含NA的式子表示)。
(4)工业上,向500—600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。
回答下列问题:
①制取无水氯化铁的实验中,装置B中加入的试剂是 。
②制取无水氯化亚铁的实验中若操作不当,制得的FeCl2会含有少量FeCl3,欲制得纯净的FeCl2,在实验操作中应先 ,再 。
【化学——选修3:物质结构与性质】
已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素原子序数为29。
(1)基态E原子的价电子排布图_______________。
(2)B、C、D三元素第一电离能由大到小的顺序为 (用元素符号表示)
(3)BD32-中心原子杂化轨道的类型为________________杂化;CA4+的空间构型为_________________。
(4)1mol BC-中含有π键的数目为________________NA。
(5)D、E元素最简单氢化物的稳定性 > (填化学式)。
(6)F元素的基态原子价电子排布式为 。
(7)C、F两元素形成的某化合物的晶胞结构如右图所示,顶点为C原子。则该化合物的化学式是 ,C原子的配位数是 。若相邻C原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为________________g/cm3(用含a、NA的符号表示)。
【化学选修——2:化学与技术】
水处理技术在生产、生活中应用广泛。
(1)根据水中Ca2+、Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。
①硬水软化的方法通常有___________、__________和离子交换法。离子交换树脂使用了一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于______________中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,__________洗涤效果较好,原因是__________________。
(2)工业上常用绿矾做混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理的水pH调到9左右,再加入绿矾。请解释这一做法的原因:__________。(用必要的离子方程式和文字描述)。
(3)最近我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是___________________。
回答下列问题:


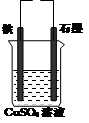
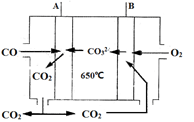
图1图2图3
(1)如图1所示为氯碱工业的模拟装置。反应的离子方程式是 。
A、B、C、D所对应物质化学式分别为 、 、 、 ,
每通过0.1mol电子,就有0.1mol (填离子符号)通过离子交换膜。
(2)在如图2所示实验装置中,石墨棒上的电极反应式为________________;总反应的化学方程式是 。
如果起始时盛有1000 mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1。若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入___________(填物质名称),其质量约为___________g。
(3)熔融碳酸盐CO燃料电池工作原理如图3所示,A、B极的电极反应分别是 、 。