第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有6个 键和1个大
键和1个大 键,苯是非极性分子
键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元 素 |
Mn |
Fe |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
Mn元素价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)铁原子核外有__________种运动状态不同的电子。
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 。

(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为 。
②与CNO-互为等电子体微粒的化学式为 (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为;
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为;
1 L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+NH4+Al3+K+ |
| 可能大量含有的阴离子 |
Cl-Br-I‑ClO‑AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(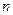 )与加入NaOH溶液的体积(
)与加入NaOH溶液的体积(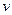 )的关系如右图所示。
)的关系如右图所示。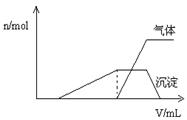
则该溶液中确定含有的离子有;
不能确定是否含有的阳离子有,
要确定其存在可补充做的实验是;
肯定不存在的阴离子有。
(2)经检测,该溶液中含有大量的Cl- 、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
2.8L |
5.6 L |
11.2 L |
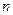 (Cl-) (Cl-) |
1.25mol |
1.5 mol |
2 mol |
 (Br-) (Br-) |
1.5 mol |
1.4 mol |
0.9 mol |
 (I-) (I-) |
 mol mol |
0 |
0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为。
A、B、C、D、E是中学常见的五种物质,其转化关系如图所示。反应I、II均在水溶液中进行,其中某些物质可能已略去。已知D是双原子分子形成的单质,C、E是化合物。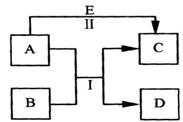
(1)若A是气态单质,其水溶液具有漂白性,D在常温下为固态。E是一种可溶性强碱,其焰色反应为黄色。则
①A、C的化学键类型分别为,;
②写出C的一种用途;
③写出A+B→C+D反应的化学方程式。
(2)若A是金属单质,D是无色气体,E是A的盐溶液。则
①D的化学式是
②A和E发生反应的离子方程式为。
(共12分)某盐X由非金属元素组成,不稳定加热时分解,生成等物质的量的气态氢化物A和B。A、C、E、G、I含有同种元素,C为黄色固体单质。B、D、F、H、J含有同种元素,B可与 J反应生成盐。W是前四周期含有4个未成对电
J反应生成盐。W是前四周期含有4个未成对电 子的金属。上述物质转化关系如图,部分产物和条件已略去。请回答下列问题:
子的金属。上述物质转化关系如图,部分产物和条件已略去。请回答下列问题: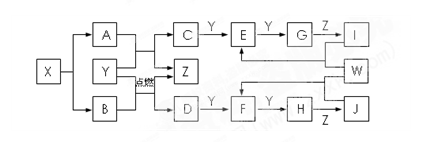
(1)X的化学式
(2)写出由E生成G的化学反应方程式
(3)写出反应B+Y →D+Z的化学方程式
(4)由E直接转换成I可以加入(填写两种属于不同类别的物质)。
(5)标况下,4.48LA与J的浓溶液反应转移1.6mole-,写出此反应的离子方程式。
(6)将1mol/L200mL I和1mol/L100mL J溶液混合,加入到含有0.5mol的W中,则产生气体的物质的量为
氯气在298K、100kPa 时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为;
(2)估算该反应的平衡常数(列计算式)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______________移动。