已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。(提示:碱石灰是生石灰与氢氧化钠的混合物,可以吸收水和二氧化碳)
主要实验步骤如下:① 按图组装仪器,并检验装置的气密性
②将10.0 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到20.0 g
④从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓通入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到22.0 g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为22.2 g
请填空和回答问题:
(1)装置中干燥管B的作用________________________。如果没有连接该干燥管,测试的结果________________________(填偏高、偏低或不变)。
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果________(填偏高、偏低或不变)。
(3)步骤⑤的目的是________________________,如果没有进行步骤⑤的操作,测试的结果________________(填偏高、偏低或不变)。
(4)试样中纯碱的质量分数为________________________。
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为::;
为了吸收该反应中产生的尾气,请选择下列中合适的装置。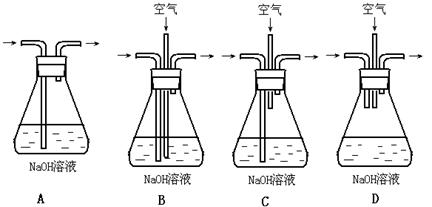
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。①方案1中的B仪器名称是。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E、Fe2(SO4)3 |
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是,
⑥本实验CuSO4·5H2O的产率为。
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
(1)验证固体W焙烧后产生的气体含有SO2的方法是:
___________________________________________________________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→____→____→____→____→f。
装置A中发生反应的化学方程式为_________________________________________。
装置D的作用是_____________,装置E中NaOH溶液的作用是__________________。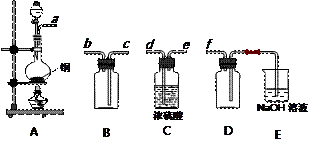
(3)制备绿矾时,向溶液X中加入过量__________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有_______________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,定容时视线应_____________________,直到_____________________。用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数______(填“偏大”、“偏小”或“无影响”)。
某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
| 实验步骤 |
向3—4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全 |
| 实验现象 |
产生白色沉淀 |
| 离子方程式 |
(1) |
| 小组讨论交流 |
向上述反应后的清液中滴入适量1mol/L的Na2CO3溶液会出现什么现象 |
| 假设出现的实验现象,说明理由 |
假设:Ⅰ无现象 理由:反应没有限度,Ca2+沉淀完全 假设:Ⅱ(2),理由:(3) |
| 证明你的假设 |
现象:产生大量的白色沉淀 |
| 离子方程式 |
(4) |
| 解释 |
(5) |
某化学兴趣小组为了探究:在常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
[提出猜想]
猜想1:;猜想2;猜想3。
为了验证猜测,该小组设计实验加以探究:
[实验探究]
该小组同学按如图所示装置,将气体从a端通入: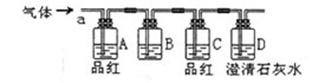
(1)B中应该装下列试剂(填编号);
| A.NaCl溶液 | B.KMnO4溶液 | C.浓溴水 | D.饱和NaHCO3溶液 |
(2)A中品红的作用是:;
(3)D中澄清石灰水的作用是:。
通过该实验,小组同学观察到以下三个实验现象:
①A中品红褪色②C中品红不褪色③D中澄清石灰水变浑浊
[得出结论]
由上述现象小组同学确认该气体的成分是。
实验室用98%的浓硫酸(其密度为1.84 g/ml)配制100 mL
1.0 mol·L-1稀硫酸。
(1)需用10 mL的量筒量取浓硫酸的体积为mL。
(2)实验时选用的仪器有10 mL量筒、烧杯、玻璃棒、、。
(3)配制过程中,下列情况会使配制结果偏低的是(填序号)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.转移液体到容量瓶中时,未洗涤烧杯就定容
C.往容量瓶转移时,有少量液体溅出
D.容量瓶使用时未干燥
E.定容时俯视刻度线观察液面
(4)在容量瓶使用方法中,下 列操作正确的是(填序号)。
列操作正确的是(填序号)。
A.容量瓶用蒸馏水洗净后,再用待配液润洗
B.使用容量瓶前检查它是否漏水
C.将氢氧化钠固体放在天 平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线