【化学—选修3:物质结构与性质】
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 。
②氨水溶液中各元素原子的第一电离能从大到小排列顺序为 ,理由是 ;其中NH3应为 (填“极性”或“非极性”)分子。
③醋酸分子中的两个碳原子的化方式分别是 。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 。(填序号)
a.离子键 b.金属键 c. 共价键 d. 配位键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。

①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞 。(填“侧面”或“内部”)
②根据以上信息可以推知,XY2晶体的熔沸点 (填“>”“=”“<”)固态氨的沸点。
③若该晶胞的边长为a nm,密度为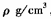 ,XY2的摩尔质量为
,XY2的摩尔质量为 ,则阿伏加德罗常数可表示为
,则阿伏加德罗常数可表示为
Ⅰ.已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“<”、“>”或“=”);
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol 的A和0.80 mol 的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=________ mol·L-1,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol 氩气,平衡时A的转化率为________;
(3)判断该反应是否达到平衡的依据为________(填正确选项前的字母);
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1 200 ℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
Ⅱ.(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
A、CO2+H2O +2NaClO===Na2CO3+2HClO
B、CO2+H2O +NaClO===NaHCO3+HClO
C、CO2 +H2O +C6H5ONa NaHCO3+C6H5OH
NaHCO3+C6H5OH
D、CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E、Na2CO3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F、CH3COOH+NaCN===CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号);其pH为___________(填数值);pH最大的_________(填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:请回答以下问题:
电解时,粗铜应与电源的极相连。阴极上的电极反应式为。电解过程中,硫酸铜的浓度会(选填:变大、不变、变小)
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子反应方程式:。残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
| 2 |
Au3+ + 4Cl— = AuCl4— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因
(2)滤液含量的测定: 以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+的浓度为mol·L—1,Fe2+的浓度为mol·L—1
A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同周期也不在同主族,D的氢化物和最高价氧化物的水化物均为强酸,且B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)A和D的氢化物中,沸点较高的是 __________(写出化学式)。
(2)写出A单质的结构式___________。B的最高价氧化物的水化物的电子式__________。
(3)写出E离子的离子结构示意图___________________。元素D在元素周期表中的位置是____________________。
(4)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,该盐的名称为 __________。它的水溶液与D的氢化物的水溶液反应可生成D的单质,该离子方程式为______________________。
(1)(6分)已知实验室制备氯气的反应:MnO2 +4HCl(浓)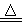 MnCl2 + Cl2↑+ 2H2O其中氧化剂是,还原剂是,氧化产物是,还原产物是,氧化剂和还原剂之比是。
MnCl2 + Cl2↑+ 2H2O其中氧化剂是,还原剂是,氧化产物是,还原产物是,氧化剂和还原剂之比是。
(2)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+=__CO2+__Mn2++__H2O
(3)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)2、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→ O2
①该反应中的氧化剂是。
②该反应中,发生还原反应的过程是→。
③写出该反应的化学方程式,并标出电子转移的方向和数目。
④如反应转移了0.6mol电子,则产生的气体在标准状况下体积为。
(6分)现有以下物质①KNO3溶液②干冰(固态的二氧化碳)③冰醋酸(纯净的醋酸)④铜⑤AgCl固体⑥蔗糖⑦酒精⑧熔融的NaCl⑨氨水⑩盐酸,其中能够导电的是_________________(填序号,下同);属于电解质的是__________________;属于非电解质的是___________________________。