已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离的程度远大于第二步电离的程度,第二步电离的程度远大于第三步电离的程度……
今有HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐→较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:①HA+HC2-(少量)=A-+H2C-;②H2B(少量)+2A-=B2-+2HA;③H2B(少量)+H2C-=HB-+H3C。回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是________。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中最易结合质子的是__________,最难结合质子的是___________。
(3)下列离子方程式中正确的是________。
A.H3C+3A-=3HA+C3-
B.HB-+A-=HA+B2-
C.H3C+B2-=HB-+H2C-
(4)完成下列反应的离子方程式:
H3C+OH-(过量)→_________;
HA(过量)+C3-→__________。
b-羧乙基锗倍半氧化物(即Ge-132)是与人体健康有关的最重要的有机锗化合物。其片层结构如图。每个结构相同的基团都是由六个锗原子和六个氧原子构成的十二元环,每个锗原子还同时与三个氧原子相连结,形成可以任意延伸的片层,每个锗原子连接一个羧乙基(-CH2CH2COOH),各片层间存在相互作用,连结成三维网状结构。
(1)每个十二元环平均拥有个锗原子,个氧原子。
(2)试写出Ge-132的化学式。
有A、B、C、D四种元素,A元素的气态氢化物分子式为RH4,其中R的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫______,其晶体类型是______晶体。
(2)B的氢化物的电子式为,属______分子。(极性或非极性)
(3)A和B形成化合物的分子空间构型为,属______分子,其晶体类型是______晶体。俗名______。
(4)C元素位于周期表中第______周期______族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)。
(5)C和D的化合物溶于水后滴入过量KOH,现象是,离子方程式。
二氧化硅晶体中,每个Si原子周围结合个O原子;同时,每个O原子跟个Si原子相结合。实际上,SiO2晶体是由Si原子和O原子按的比例所组成的立体网状结构;晶体中最小的环是由个Si原子和个O原子组成的元环;1mol SiO2中含molSi—O键。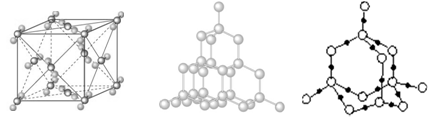
干冰晶胞金刚石晶体结构二氧化硅晶体结构
金刚石晶体中每个碳原子都采取杂化,被相邻的个碳原子包围,以共价键结合形成;晶体中最小的碳环由个碳组成,且同一平面内;晶体中每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子与C—C键数之比为;1mol金刚石中含有molC—C键。
干冰晶胞中平均含有个CO2分子;CO2分子的排列方向有种;与一个CO2分子距离最近且相等的CO2分子共有个。