化学学习活动小组学习了铁铜化合物知识后,查阅资料,积极思考,提出了一系列问题,请予以解答:
(1)氯化亚铜(CuCl)是重要的化工原料,工业上常通过下列反应制备CuCl
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
查阅资料可得,CuCl可以溶解在FeCl3溶液中,请写出该反应的离子方程式是
(2) 已知:Cu2O在酸溶液中发生歧化反应:Cu2O+2H+==Cu2+ +Cu +H2O
现将一定量混合物(Fe2O3、Cu2O、CuCl、Fe)溶解于过量稀盐酸中,反应完全后,得到W(包括溶液和少量剩余固体),此时溶液中一定含有的阳离子 (用离子符号表示);继续往W中通入足量的氯气,不断搅拌,充分反应,溶液中哪些离子的物质的量一定有明显变化 (用离子符号表示);不通入气体,改往W中加入过量铁粉,过滤,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3 mol电子,该反应的离子方程式是 。
生活中常用药品很多,如:①碘酒、②麻黄碱、③青霉素、④阿司匹林、⑤葡萄糖注射液、⑥胃舒平(含氢氧化铝、淀粉等)。
(1)上述物质中属于抗生素的是_____(填写序号,下同),具有止咳平喘作用的天然药物是 。
胃舒平可防治胃酸分泌过多,其发挥功效时的离子方程式为 。
(2)低血糖病症发作时,喝葡萄糖水可快速见效。葡萄糖作为营养剂供给人体能量,在体内发生的主要反应是_________(填写字母,下同)。
| A.加成反应 | B.取代反应 | C.氧化反应 | D.聚合反应 |
(共11分)拆开1mol H—H键,1mol N—H键,1mol N三N键分别需要吸收的能量为436kJ ,391kJ,946kJ(计算结果保留到整数)
写出此反应的热化学方程式(此空5分)
则1mol N2 完全生成NH3热量(填:吸收或放出) kJ;
1mol H2完全生成NH3 热量(填:吸收或放出) kJ;
理论上,完全分解1mol NH3热量(填:吸收或放出) kJ
将33.6L(标况下)乙烯和甲烷混合气体,通入足量的溴水中,充分反应后,水溶液的质量增加了14g。则原混合气体中乙烯与甲烷的体积之比为
写出下列化学方程式(共6分)
(1) 乙炔与氯化氢按物质的量比1:1反应
(2) 苯与浓硝酸、浓硫酸的混合酸共热__________
下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合(氢原子省略)。回答下列问题: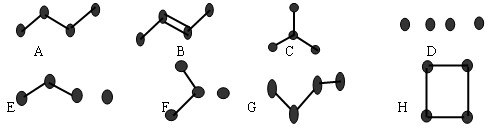
(1)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可
以形成 和 ,还可以形成碳环。
(2)图中属于烯烃的是(填编号)
(3)与A 互为同分异构体的是(填编号)
( 4) 写出上图中B、C、G的结构简式
B 、C 、G .