半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;②PCl3遇水会强烈水解生 成 H3PO3和HC1;③PCl3遇O2会生成P0Cl3,P0Cl3溶于PCl3;④PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为______________;
(2)F中碱石灰的作用是_____________、_________________________;
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是______________;
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后.通过_________填实验操作名称),即可得到较纯净的PCl3;
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为______________;
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定
③重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为_________。
某学生发现氯水能使有色布条褪色,氯水的成分比较复杂,那么氯水中究竟什么成分具有漂白性呢?带着疑问,他做了如下探究:
(1)查找资料后得知氯水的成分有____、___、____、____。
(2)根据资料查阅和实验结果分析, 新制的氯水呈____色,氯水中含有多种微粒.将紫色石蕊试液滴入其中,溶液显红色.起作用的微粒是;过一会儿,溶液的颜色逐渐褪去,起作用的微粒是。该物质之所以具有漂白性,与它的______(填性质)有关。往氯水中滴入硝酸银溶液,产生白色沉淀,起作用的微粒是。氯水能使淀粉碘化钾试纸变蓝,起作用的是.(本小题中除第一个外,其余每个空格处都请填写微粒的符号)
(3)从以上过程可看出,该学生的探究活动体现了最基本的科学研究方法,即:
对于下列所示实验操作,完全正确是 ()
A B C
课题式课堂教学是“研究性学习”的方式之一,其基本模式为:提出课题→确定研究方案→解决问题→总结和评价。下页图是关于“CO的化学性质”的课题式课堂教学“解决问题”阶段中,甲同学设计的证明“CO具有还原性”的实验装置。
(1)气体验纯后开始进行实验,实验时应先点燃 处
(填“A”或“B”)的酒精灯。
(2)反应一段时间后,可观察到洗气瓶中的现象为 ,加热的玻璃管里的现象为 。
(3)酒精灯B的作用是 。
(4)乙同学提出甲同学设计的装置太复杂,认为可将酒精灯合二为一,去掉B,而将尾气导管口旋转到A的火焰上即可,乙同学的设计是否合理? (填“合理”或“不合理”),理由是。
(5)丙同学质疑“CO能否使澄清的石灰水变浑浊”,该同学设计CO通入CuO之前,应先通过澄清石灰水,以排除CO与澄清石灰水反应。试对此作出评价,认为丙的设计(填“必要”或“不必要”),理由是
。
(6)丁同学认为甲同学的设计的装置中的尾气处理还可以有其他的方法,请你为丁同学设计一种合理的尾气处理方法
。
实验室配制500 mL 0.1mol·L-1的氢氧化钠溶液的实验步骤如下:
a.计算需要氢氧化钠固体的质量。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
回答下列问题:
(1)需称量g的氢氧化钠, 氢氧化钠固体应放在仪器中称量。
(2)上述步骤的正确操作顺序是(填序号)。
(3)上述实验,除用到托盘天平、500mL容量瓶 、烧杯、胶头滴管、药匙外,还用到。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: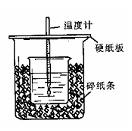
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”)。