已知:(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1
(2)C(s)+O2(g)=CO2(g) △H2 (3)2H2(g)+O2(g)=2H2O(l) △H3
(4)2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l) △H4
(5)2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H5
下列关于上述反应的焓变的判断正确的是
| A.△H1>0,△H2<0 | B.△H5=2△H2+△H3-△H1 |
| C.△H3>0,△H5<0 | D.△H4=△H1-2△H3 |
关于平衡常数,下列说法不正确的是( )
| A.平衡常数不随反应物或生成物的浓度的改变而改变 |
| B.平衡常数随温度的改变而改变 |
| C.平衡常数随压强的改变而改变 |
| D.使用催化剂不能使平衡常数增大 |
某温度时,反应SO2(g)+O2(g) SO3(g)的平衡常数K=50,在同一温度下,反应2SO3(g)
SO3(g)的平衡常数K=50,在同一温度下,反应2SO3(g) 2SO2(g)+O2(g)的平衡常数K'应为( )
2SO2(g)+O2(g)的平衡常数K'应为( )
| A.2 500 | B.100 | C.4×10-4 | D.2×10-2 |
中和热测定实验中,下列操作一定会降低实验准确性的是( )
| A.用滴定管取所用药品 |
| B.NaOH溶液在倒入小烧杯时,有少量溅出 |
| C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多 |
| D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度 |
已知盐酸与硫酸跟烧碱的稀溶液反应的热化学方程式为:H+(aq)+OH-(aq) H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq)
H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq) K2SO4(aq)+2H2O(l) ΔH=Q2 kJ·mol-1。则Q1和Q2的关系是( )
K2SO4(aq)+2H2O(l) ΔH=Q2 kJ·mol-1。则Q1和Q2的关系是( )
| A.Q1=Q2 | B.2Q1=Q2 | C.Q1<Q2 | D.无法判断 |
将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50)。下列叙述正确的是( )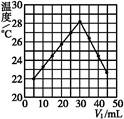
| A.做该实验时环境温度为22 ℃ |
| B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约为1.00 mol·L-1 |
| D.该实验表明有水生成的反应都是放热反应 |