Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g) 设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:
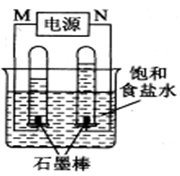
①燃料电池即电源的N极的电极反应式为 _______________________;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g)  N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂 C.减小容器体积 D.扩大容器体积
(14分)雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:2SO2(g)+O2(g)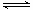 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)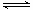 2NO2(g)ΔH=-113.0 kJ·mol-1
2NO2(g)ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)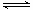 SO3(g)+NO(g)ΔH=kJ·mol-1。
SO3(g)+NO(g)ΔH=kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有。
a.体系密度保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K=。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。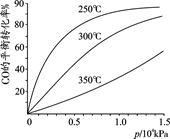
(3)下图是一种用NH3脱除烟气中NO的原理。
①该脱硝原理中,NO最终转化为H2O和(填化学式)。
②当消耗1 mol NH3和0.5 molO2时,除去的NO在标准状况下的体积为L。
(4)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示,写出NO分解的化学方程式。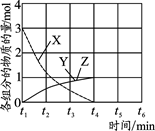
【化学—选修3:物质结构与性质】在研究金矿床物质组分的过程中,通过分析发现了Cu-Ni-Zn-Sn-Fe多金属互化物。
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于(填“晶体”或“非晶体”),可通过方法鉴别。
(2)基态Ni2+的核外电子排布式;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于晶体;Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiOFeO(填“<”或“>”)。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是;写出一种与SCN—互为等电子体的分子(用化学式表示)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为。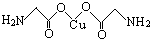
(5)立方NiO(氧化镍)晶体的结构如图-1所示,其晶胞边长为apm,列式表示NiO晶体的密度为g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)。人工制备的NiO晶体中常存在缺陷(如图-2):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为。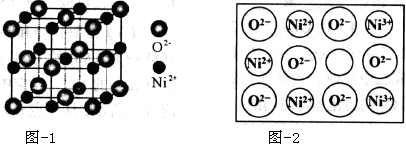
SO2、NO2、可吸人颗粒物是雾霾的主要组成。
(1)SO2可用氢氧化钠来吸收。现有0.4 molSO2,若用200 mL,3mol·L—1NaOH溶液将其完全吸收,生成物为(填化学式)。经测定所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为。
(2)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:。
(3)氮氧化物和碳氧化物在催化剂作用下可发生反应:2CO+2NO N2+2CO2,在体积为0.5L的密闭容积中,加入0.40mol的CO和0.40 mol的NO,反应中N2的物质的量浓度的变化情况如图所示,从反应开始到平衡时,CO的平均反应速率υ(CO)=。
N2+2CO2,在体积为0.5L的密闭容积中,加入0.40mol的CO和0.40 mol的NO,反应中N2的物质的量浓度的变化情况如图所示,从反应开始到平衡时,CO的平均反应速率υ(CO)=。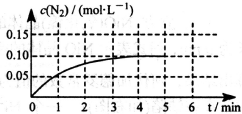
(4)用CO2合成二甲醚的化学反应是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H>0。
CH3OCH3(g)+3H2O(g)△H>0。
合成二甲醚时,当氢气与二氧化碳的物质的量之比为4︰1,CO2的转化率随时间的变化关系如图所示。
①A点的逆反应速率υ逆(CO2)B点的正反应速率为υ正(CO2)(填“>”、“<”或“=")。
②氢气的平衡转化率为。
(5)液氨作为一种潜在的清洁汽车燃料,它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H1 ①
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H2 ②
4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1=。
【化学——选修3:物质结构与性质】(15分)含氮化合物种类繁多,卟吩(下图A)连有取代基时即称为卟啉,卟啉的四个氮原子易与金属离子结合生成叶绿素(下图B)等多种物质。请回答: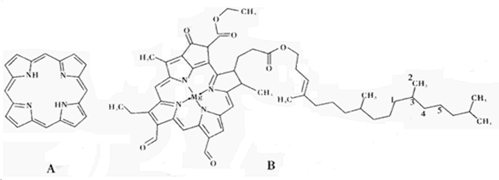
(1)卟吩中N原子采用的轨道杂化方式是_________
(2)下列有关叶绿素分子的说法正确的是_________(填选项序号)。
A.图中1—5号C中有三个具有手性
B.分子中存在配位键
C.图中1、2、3、4号C共面
D.N的第一电离能大于O
(3)卟啉与Fe2+合即可形成血红素,Fe2+的电子排布式为_________
(4)氰化氢(HCN)是一种含氮剧毒化合物,其分子中 键与
键与 键的个数比为_________。由分子结构推测,氰化氢_________(填“易”或“不易”)溶于水,原因是_________。氰化氢进人人体后产生的CN-能使人迅速中毒,请举出两种CN-的等电子体_________。
键的个数比为_________。由分子结构推测,氰化氢_________(填“易”或“不易”)溶于水,原因是_________。氰化氢进人人体后产生的CN-能使人迅速中毒,请举出两种CN-的等电子体_________。
(5)N与B能够形成一种硬度接近金刚石的物质,其晶体结构如图,若其晶胞边长为a pm,则其密度为_________g·cm(只列算式)。
【化学选修3-物质结构与性质】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
| a |
原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b |
基态原子的p轨道电子数比s轨道电子数少1 |
| c |
在周期表所列元素中电负性最大 |
| d |
位于周期表中第4纵行 |
| e |
基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于________区的元素,其基态原子的价电子排布图为_________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为________;A的中心原子的轨道杂化类型为________;与A互为等电子体的一种分子为________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为________,若该晶体的相对分子质量为M,密度为ag/cm ,则晶胞的体积为________(
,则晶胞的体积为________( 用表示阿伏加德罗常数的值)。
用表示阿伏加德罗常数的值)。