氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式 ;不直接用Cl2作漂白剂的原因是 (写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
| A.臭氧 | B.NH3 | C.明矾 | D.ClO2 |
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是 和 。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③已知:2H2O2(l)=2H2O(l)+O2(g) ΔH1 = -196.46 kJ·mol-1
H2(g)+1/2O2(g)= H2O(l) ΔH2 = -285.84 kJ·mol-1
Cl2(g)+H2(g)=2HCl(g) ΔH3 = -184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。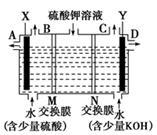
(1)X极与电源_________(填“正”或“负”)极相连,氢气从_________(填 “B” 或“C” )口导出。
(2)离子交换膜只允许一类离子通过,则M为__________交换膜(填“阴离子”或“阳离子”,下同),N为_________交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为_____________________。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是_________,转移的电子数为________________。
3.01×1023个氨分子(NH3)含__________mol氨分子,____________mol氢原子,__________mol质子_____________个电子。
今有七种物质: ①铝线 ②熔化的KNO3 ③NH3④NaCl晶体⑤液态氯化氢 ⑥石灰水 ⑦乙醇 ⑧二氧化碳,其中属于电解质的是 ,属于非电解质的是 ,上述状态下能导电的是
用反应的化学方程式表示下列几种常见离子的检验方法。
(1)NH4Cl中的NH4+检验 ;
(2)NaCl中的 Clˉ检验 ;
(3)K2SO4中的SO42ˉ检验 。
将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应 3A(g)+B(g) xC(g)+2D(g),经过4min时,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1,A在4 min末的浓度是___________,B的平均反应速率是______ __,x的值是 。
xC(g)+2D(g),经过4min时,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1,A在4 min末的浓度是___________,B的平均反应速率是______ __,x的值是 。