甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g)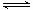 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g)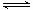 CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“II”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断反应I为______热反应(填“吸”或“放”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从表中选择)。
(2) 已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
② 2CO(g)+ O2(g)= 2CO2(g) ΔH2 kJ/mol
③ H2O(g)= H2O(l) ΔH3 kJ/mol
则反应CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH= kJ/mol
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O2‾7)时,实验室利用下图装置模拟该法:

① N电极的电极反应式为 。
② 请完成电解池中Cr2O2‾7转化为Cr3+的离子反应方程式:
Cr2O7 2‾+ Fe2+ + [ ] ═= Cr3++ Fe3++ H2O
(4) 处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10‾5 mol•L﹣1时,Cr3+沉淀完全,此时溶液的pH= 。(已知, Ksp[Cr(OH)3]=6.4×10‾31,lg2=0.3)
(1)将NaOH溶液滴入FeSO4溶液中,能观察到的现象是。
(2)向10mL lmol/L的NaOH溶液中加入10mL l mol/L的H2SO4溶液,加热、蒸干,得到固体A的化学式是。
(3)向40mL 1mol/L的NaOH溶液中通入过量的CO2,并将溶液分成两等份。
①一份加热、蒸干、灼烧,所得固体的化学式是。
②将(2)中所得固体A全部放入另一份溶液中,发生反应的离子方程式是。混合后的溶液充分搅拌后,加热、蒸干、灼烧,所得固体中两种阴离子的物质的量之比是。
(1)将SO2和Cl2分别通入装有品红溶液的两个试管中,两溶液的红色均褪去。加热后,有一支试管中的溶液又呈现红色,该试管通入的气体是,该实验说明的问题是。
(2)将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色。为检验两种气体在溶液中是否发生了氧化还原反应,应向所得溶液加入的试剂是(填化学式)。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是。
已知下图中H是无色液体,号称生命之源,B是空气中含量最多的物质,E是红棕色气体。
(1)C的化学式是。
(2)D和E都是大气污染物,两种物质相互转化的化学方程式分别是:
①D→E。
②E→D。
(3)E和H的反应中,氧化剂和还原剂的质量比是。
(4)C和F反应生成G的化学方程式是。
(1)下列两组无色溶液分别选用一种试剂鉴别,写出试剂的化学式。
①NaCl Na2CO3 Na2SiO3 Na2SO3试剂:
②(NH4)2SO4 NH4C1 Na2SO4 NaCl试剂:
(2)下列物质中含有少量杂质(括号内物质为杂质),用离子方程式表示除去杂质的原理
| 编号 |
物质 |
离子方程式 |
| ① |
NaHCO3(Na2CO3) |
|
| ②[ |
SiO2(CaCO3) |
|
| ③ |
Fe2O3(Al2O3) |
|
| ④ |
FeCl2(FeCl3) |
写出下列反应的化学方程式
(1)过氧化钠与二氧化碳:
(2)二氧化硫与氧气:
(3)铜与浓硫酸:(标出电子转移的方向和数目)