已知25 ℃时,CH3COONH4溶液呈中性。
Ⅰ.将0.1 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合(混合溶液的体积变化忽略不计),测得混合溶液的pH=9。回答下列问题:
(1)用离子方程式表示混合溶液的pH=9的原因________________________。
(2)混合后溶液中c(CH3COOH)=_________________mol·L-1 (填写精确值)。
(3)相同温度相同浓度的下列四种溶液:①(NH4)2CO3②CH3COONH4③(NH4)2SO4④NH4Cl,pH由大到小的排列顺序为____________________(填序号)。
Ⅱ. Mg(OH)2沉淀可溶解于NH4Cl溶液。同学对有关该反应的原理的解释如下:甲同学认为是NH4Cl水解,溶液呈酸性,H+中和了Mg(OH)2电离出的OH-导致沉淀溶解;乙同学认为是NH与Mg(OH)2电离出的OH-反应生成弱电解质NH3·H2O,导致沉淀溶解。
(4)丙同学不能肯定哪位同学的解释合理,于是选用下列一种试剂来验证甲、乙两同学的观点,他选用的试剂是( )
| A.NH4NO3 | B.CH3COONH4 | C.Na2CO3 | D.NH3·H2O |
(5)丙同学选择该试剂的理由是:_____________________。
(6)丙同学将所选试剂滴加到Mg(OH)2悬浊液中,Mg(OH)2溶解,由此可知:________(填“甲”或“乙”)的解释更合理。Mg(OH)2沉淀与NH4Cl溶液反应的离子方程式为:____________________。
(7)现有Mg(OH)2和Al(OH)3沉淀的混合物,若除去Mg(OH)2得到纯净的Al(OH)3,可用______________(填写所用试剂的化学式,试剂从本题涉及的试剂中选取,下同);若除去Al(OH)3得到纯净的Mg(OH)2,可用_________________。
含苯酚的工业废水处理的流程图如下所示: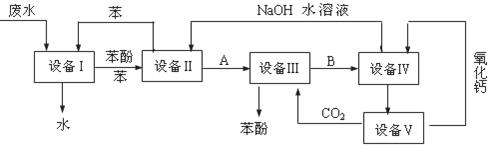
(1)上述流程里,设备Ⅰ中进行的是______________操作(填操作名称),实验室里这一步操作可以用_______________进行(填仪器名称)。
(2)由设备Ⅱ进入设备Ⅲ的物质A是__________,由设备Ⅲ进入设备Ⅳ的物质B是
(3)在设备Ⅲ中发生反应的化学方程式为。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和,通过操作(填操作名称)可使产物相互分离。
(5)图中,能循环使用的物质是C6H6、CaO、、。
乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点,而且具有较好的经济效益和社会效益,终将成为汽油和柴油的替代品。
(1)写出乙醇完全燃烧的化学方程式:______________________________。
(2)乙醇燃烧时如果氧气不足,可能还有CO生成。用如图装置验证乙醇的燃烧产物中有CO、CO2、H2O,应将乙醇的燃烧产物依次通过(按气流从左到右的顺序填装置编号)________。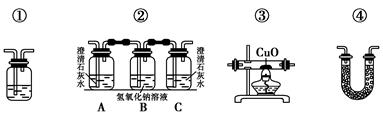
(3)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是________________;B瓶溶液的作用是________________;C瓶溶液的作用是_________________________。
(4)装置③的作用是________________;装置①中所盛放的是________________,作用是_______________________________________。
(5)装置④中所盛的固体药品是______________,它可以验证的产物是_____________。
(6)尾气应如何处理?___________________。
(7)海底有大量的甲烷水合物。等质量的甲烷和乙醇完全燃烧产生温室气体CO2较多的是________。
(1)一定条件下某烃与H2按物质的量之比1:2加成生成 ,则该烃的结构简式可能为:、。
,则该烃的结构简式可能为:、。
(2)某有机物X分子中只含C、H、O三种元素,相对分子质量小于110,其中氧元素的质量分数为14.8%,已知该物质可与FeCl3溶液发生显色反应,则X的分子式为__________。若1 mol X与浓溴水反应时消耗了3 mol Br2,则X的结构简式为。
(3)分子式为C4H8的烃,核磁共振氢谱图中有两个吸收峰,峰面积比为3:1,请写出符合条件的所有物质的结构简式、。
下列括号内为杂质,将除去下列各组混合物中杂质所需的试剂和方法填写在横线上。
溴乙烷(乙醇)_______________,________________
苯酚(苯)_______________,______________________________________
写出②操作中涉及到的反应的化学方程式______________________________________、
______________________________________
(5)已知: ,如果要合成
,如果要合成 所用的原始原料可以是
所用的原始原料可以是
A.2-甲基-l,3-丁二烯和2-丁炔
B.2,3-二甲基-1,3-戊二烯和乙炔
C.2,3-二甲基-l,3-丁二烯和丙炔
D.1,3-戊二烯和2-丁炔
写出下列反应的化学方程式,并指出反应类型:
(1)实验室制乙烯()
(2)用甲苯制备TNT()
(3)苯酚和浓溴水的反应()
(4)1,2-二溴乙烷与足量氢氧化钠的乙醇溶液加热:( )
(5)2-丙醇与氧气在催化剂作用下反应()
①标准状况下,甲烷和一氧化碳的混合气体共8.96L,其质量为7.6g,则混合气体中甲烷的体积为,一氧化碳的质量为。
②在标况下气体A的密度为1.25g/L,气体B的相对分子质量为42,A和B的混合气体在相同状况下对H2的相对密度为16.8,则混合气体中A和B的体积比为 。